Diagnostic biologique des thrombopénies induites par l’héparine (TIH) : propositions concernant la réalisation des tests fonctionnels et les algorithmes diagnostiques
INTRODUCTION
La thrombopénie induite par l’héparine (TIH) est un syndrome clinico-biologique rare, iatrogène, caractérisé par la survenue d’une diminution de la numération plaquettaire au cours d’un traitement par l’héparine. La reconnaissance précoce des signes cliniques associée à un diagnostic biologique rapide et spécifique permet d’initier rapidement un traitement anticoagulant non héparinique, indispensable en raison du risque majeur de complications thrombotiques. L’objectif de ce document est de guider le clinicien et le biologiste dans la prescription, la réalisation et l’interprétation des tests biologiques permettant une prise en charge optimale du patient suspect de TIH.
Ce texte succède à celui publié dans le précédent numéro de la RFHT et concerne spécifiquement la réalisation et l’interprétation des tests fonctionnels ainsi que la stratégie diagnostique à mettre en place lors d’une suspicion de TIH.
Après analyse de la littérature et discussions, 81 propositions ont été rédigées et soumises à un vote en ligne auprès des membres de la SFTH et 38 réponses ont été obtenues. Parmi les 54 propositions présentées dans ce texte, 53 ont reçu un accord professionnel fort (avec ≥ 70 % d’avis favorables ou très favorables). La seule proposition n’ayant pas atteint ce critère a été supprimée. Compte tenu des commentaires exprimés, 9 propositions ont été reformulées et 2 ajoutées. Sept de ces propositions ont été soumises à un 2e vote.
Réalisation et interprétation des tests fonctionnels de diagnostic de TIH
Les tests d’activation plaquettaire sont utilisés pour détecter les anticorps pathogènes et permettent de confirmer le diagnostic de TIH. Tous reposent sur la mise en évidence d’une activation des plaquettes de sujets sains en présence du plasma ou du sérum du patient et d’héparine. Chaque test est défini par le marqueur d’activation plaquettaire étudié, son mode de détection et le milieu réactionnel utilisé (Figure 1).
Plusieurs tests fonctionnels reposent sur l’étude de l’agrégation plaquettaire, détectée :
• par transmission lumineuse en utilisant du plasma riche en plaquettes (PRP) (test d’agrégation plaquettaire ou TAP) ou des plaquettes lavées (1,2) ;
• à l’œil nu si le test est réalisé sur microplaque avec des plaquettes lavées (Heparin Induced Platelet Aggregation ou HIPA) (3) ;
• par impédancemétrie, si le test est réalisé sur sang total (Heparin Induced Multi-Electrode Aggregometry ou HIMEA) (4).
D’autres tests d’activation plaquettaire reposent sur la mise en évidence de modifications d’expression des protéines et des phospholipides membranaires en cytométrie en flux (CMF). Les marqueurs les plus couramment utilisés sont la P-sélectine (CD62P) (5) et la phosphatidylsérine (PS) marquée par l’annexine V (AnxV) (6). La libération de vésicules extracellulaires ou microvésicules plaquettaires peut également être quantifiée par CMF sur des critères de taille, d’expression de la PS et de la GPIIb/IIIa (7) ou de la GPIb (8).
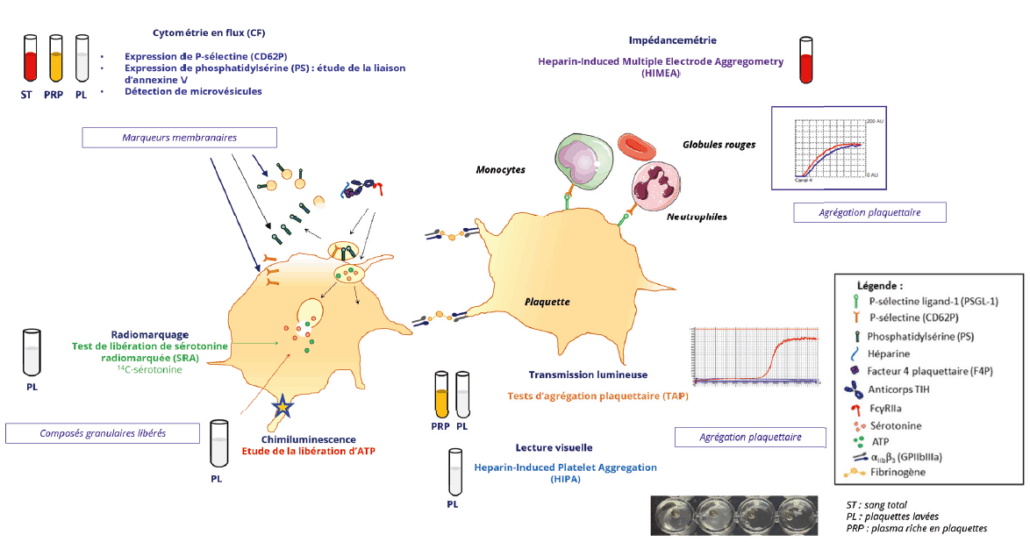
Figure 1 : Résumé des tests fonctionnels évaluant l’activation plaquettaire lors de la TIH.
Figure 1: Summary of functional tests assessing platelet activation during HIT.
L’évaluation de la libération du contenu des granules plaquettaires au cours de l’activation des plaquettes est également utilisée dans deux autres tests fonctionnels : le test de libération de sérotonine radiomarquée (SRA, Serotonin Release Assay) (9) et le test de libération d’ATP (ATP release) (10), tous deux réalisés sur plaquettes lavées.
Quelles variables pré-analytiques liées au donneur de plaquettes faut-il maîtriser lors de la réalisation de ces tests ?
Doit-on sélectionner les donneurs ? Si oui, comment ?
Propositions
Afin de réduire les variabilités inter- et intra-individuelles de réponse des plaquettes aux anticorps de TIH :
– Il est proposé de sélectionner, si possible, des donneurs de plaquettes « bons répondeurs ».
– La sélection d’un donneur « bon répondeur » peut être réalisée à l’aide d’un échantillon de patient TIH ou de l’anticorps monoclonal 5B9 commercialisé qui sera testé à une concentration comprise entre 100 et 200 µg/mL.
– Il est nécessaire de s’assurer que le donneur n’a pris aucun médicament impactant les fonctions plaquettaires au cours de la semaine précédant le prélèvement.
Rationnel
En préambule, il est nécessaire de souligner qu’en France le prélèvement de sujets « témoins » est encadré par
l’article L. 1221-4 du code de la santé publique (CSP) :
« Le sang, ses composants et leurs dérivés peuvent être distribués et utilisés à des fins de recherche, de contrôle des examens de biologie médicale ou de contrôle des dispositifs médicaux de diagnostic in vitro, à l’exclusion de toute administration à l’homme, avant l’obtention des résultats des examens biologiques et des tests de dépistage prévus au premier alinéa. » Toutefois, l’article L. 1221-3 précise que « le prélèvement ne peut être fait qu’avec le consentement du donneur par un médecin ou sous sa direction et sa responsabilité ».
La variabilité de réponse des plaquettes de sujets sains aux anticorps de TIH est décrite dans de nombreux travaux (2,11). Les interférences acquises les mieux connues sont le tabac et les médicaments (anti-agrégants plaquettaires, anti-
inflammatoires non stéroïdiens, inhibiteurs de la recapture de la sérotonine…) (12,13). Il est ainsi recommandé de tester les plaquettes de plusieurs donneurs et/ou de sélectionner les donneurs « bons répondeurs » aux anticorps de TIH. Cette variabilité de réponse n’est expliquée ni par le phénotype ABO, ni par le nombre de récepteurs FcγRIIA à la surface des plaquettes (11), mais le polymorphisme H/R en position 131 de FcγRIIA semble influencer la réponse plaquettaire. Ainsi, il est montré que les plaquettes H/H 131 sont moins réactives car plus sensibles à un effet inhibiteur des IgG2 normales et l’utilisation de plaquettes des sujets R/R 131 pourrait permettre d’améliorer les performances des tests réalisés en milieu plasmatique (14).
Les recommandations émises pour les tests évaluant les fonctions plaquettaires dans le cadre de l’exploration des thrombopathies (13) peuvent être appliquées pour les tests fonctionnels de TIH. Les plaquettes doivent être collectées à partir de donneurs sains après une courte période de repos, à distance de toute consommation de tabac (> 30 minutes), de caféine (> 2 heures), d’alcool et de tout médicament susceptible d’interférer avec la réactivité plaquettaire : AINS (> 3 jours), aspirine, anti-P2Y12, inhibiteurs de recapture de la sérotonine (> 10 jours) (15). Dans tous les cas, un inventaire de tout traitement pris par le donneur au cours de la semaine précédant le test doit être envisagé en cas de non-réponse de ses plaquettes à un contrôle positif (16).
Dans la mesure où le laboratoire a la possibilité de connaître l’origine de ses donneurs et de les sélectionner, plusieurs outils ont été proposés avec leurs avantages et leurs inconvénients. L’utilisation d’un anticorps monoclonal murin anti-CD9 qui induit une activation plaquettaire FcγRIIa-
dépendante a été proposée (17). Cependant, l’anticorps utilisé (ALB6) est une IgG1 murine qui possède une faible affinité pour l’isoforme H131 (18). Certains auteurs proposent d’utiliser le plasma ou le sérum dilué d’un échantillon de TIH avec une DO très élevée, et de préparer un échantillon faiblement positif permettant de sélectionner un bon répondeur (19). Il est en effet montré que certains échantillons de TIH avec une DO très élevée sont capables d’activer les plaquettes issues de nombreux donneurs non sélectionnés et de tels échantillons, s’ils sont testés purs, ne permettent donc pas de sélectionner les bons répondeurs (19).
L’anticorps monoclonal anti-F4P/H, 5B9, possède un fragment Fc humain et mime donc parfaitement tous les effets cellulaires des anticorps de TIH. Il a été validé par une étude multicentrique soutenue par le sous-comité de standardisation « Platelet Immunology » de l’ISTH, et qui a évalué son usage avec les tests fonctionnels les plus utilisés en pratique. L’anticorps 5B9 est donc aujourd’hui considéré comme un bon outil pour sélectionner des donneurs lorsqu’il est utilisé à une concentration comprise entre 100 et 200 µg/mL (20).
Il est important aussi de préciser qu’il est nécessaire de tester un contrôle positif et un contrôle négatif lors de chaque série de tests réalisée.
Faut-il tester l’échantillon du patient suspect de TIH systématiquement avec les plaquettes de plusieurs donneurs ?
Si oui, combien ?
Propositions
– Sauf cas particulier, il est nécessaire de tester les plaquettes d’au moins deux donneurs différents.
– Un test d’activation plaquettaire positif avec un seul donneur peut suffire à confirmer le diagnostic de TIH sous réserve de la conformité des contrôles internes, d’un test immunologique positif et d’une probabilité clinique intermédiaire ou élevée de TIH.
– En cas de test fonctionnel négatif et de probabilité élevée de TIH et/ou de fort titre d’anticorps détecté par un test immunologique, il est recommandé de tester l’échantillon avec au moins 3 donneurs avant de conclure que le test fonctionnel est négatif ou d’avoir recours à un autre test fonctionnel plus sensible (SRA, HIPA).
Rationnel
Il n’existe actuellement aucun consensus sur le nombre de donneurs à tester : le nombre de donneurs utilisés pour réaliser les tests fonctionnels varie de 1 à 5 selon les études et selon les méthodes (3,21-23).
L’impact du polymorphisme FcγRIIA sur la réponse plaquettaire aux anticorps de TIH a été clairement démontré lorsque les plaquettes sont activées en milieu plasmatique (14). Ainsi, des plaquettes H/H131 testées en matrice plasmatique peuvent ne pas répondre aux anticorps de TIH alors qu’après lavage de celles-ci, une réponse adéquate est observée. L’utilisation de 3 à 5 donneurs différents permet de s’affranchir de la variabilité de réponse des plaquettes d’un donneur à l’autre. Certains auteurs préconisent de conclure un test comme étant positif (HIPA et TAP) si une agrégation est obtenue avec au moins deux donneurs de plaquettes (24). Il peut cependant être difficile d’obtenir des plaquettes de plusieurs donneurs différents le même jour, aussi est-il possible de les tester à des jours différents.
Quel délai entre le prélèvement du donneur et la réalisation des tests ?
Proposition
– Les tests fonctionnels doivent être réalisés moins de 4 heures après le prélèvement du donneur.
Rationnel
L’étude des fonctions plaquettaires est un examen particulièrement sensible aux paramètres pré-analytiques (qualité du prélèvement, délai entre le prélèvement et la réalisation de l’analyse, conditions d’acheminement et préparation de l’échantillon). Après le prélèvement sanguin, les plaquettes ont une durée de vie limitée estimée à 4 heures maximum en PRP (13) et comprise entre 5 et 8 heures avec des plaquettes lavées (25).
Quels sont les points méthodologiques critiques à maîtriser ?
Quel délai entre la suspicion de TIH et la réalisation d’un test fonctionnel ?
Proposition
– Les tests fonctionnels doivent être faits sur un prélèvement réalisé le plus précocement possible par rapport à la suspicion clinique de TIH, idéalement sur le même prélèvement que celui utilisé pour le test immunologique.
Rationnel
La TIH est classiquement une pathologie auto-immune médicamenteuse et les anticorps anti-F4P/H disparaissent assez rapidement après l’arrêt du traitement par héparine. Ainsi, la durée médiane de persistance des anticorps après un épisode de TIH varie selon le test réalisé : 50 jours si les anticorps sont recherchés avec un SRA et 85 jours par un test immunologique (26). Ceci explique pourquoi il est important de tester les patients ayant une suspicion de TIH à la phase aiguë ou peu après la correction de la numération plaquettaire. Une attention particulière doit être portée aux patients prélevés alors qu’ils sont traités par danaparoïde
sodium. En effet, ce médicament, à la différence du
fondaparinux ou de l’argatroban, interfère avec la formation des complexes immuns (F4P-héparine-IgG) et peut induire des résultats faussement négatifs avec les tests d’activation plaquettaire (27). De plus, les IgIV administrées aux patients peuvent également inhiber les tests fonctionnels (28-30).
Quelles concentrations d’héparine doivent être testées ?
Propositions
– Deux concentrations faibles d’héparine comprises entre 0,1 et 1 UI/mL doivent systématiquement être testées.
– Si le test d’activation plaquettaire est positif aux faibles concentrations d’héparine :
o Une forte concentration d’héparine doit systématiquement être testée :
■ comprise entre 10 et 100 UI/mL lorsque les tests sont effectués sur PRP ou plaquettes lavées ;
■ comprise entre 200 et 500 UI/mL si le test est réalisé sur sang total.
o Une condition sans héparine peut être réalisée pour détecter une activation des plaquettes sans héparine qui peut être associée à une plus forte pathogénicité des anticorps et par conséquent à un tableau clinique plus sévère.
Rationnel
La réalisation d’un test fonctionnel nécessite de tester l’héparine à une relativement faible et à une forte concentration. La faible concentration, par exemple 0,5 UI/ml, correspond à une concentration thérapeutique d’héparine et permet de reproduire in vitro l’activation plaquettaire induite in vivo par les anticorps de TIH. La forte concentration d’héparine est supra-thérapeutique, induit une dissociation des complexes héparine/F4P et inhibe ainsi l’activation plaquettaire induite par les anticorps de TIH. Le caractère héparine-dépendant de l’activation plaquettaire doit être vérifié à l’aide de cette forte concentration d’héparine afin d’affirmer la spécificité du résultat. En effet, des tests fonctionnels faussement positifs ont été mis en évidence notamment chez les patients septiques (31,32).
L’héparine non fractionnée est le plus souvent utilisée à des concentrations qui varient de 0,1 à 1 UI/mL selon les tests et les auteurs (33) (Tableau 1). Dans un grand nombre de cas, deux concentrations thérapeutiques d’héparine sont testées pour augmenter la sensibilité du test. En effet, selon les échantillons de TIH ou les fractions d’anticorps testés (car la réponse immune est polyclonale), le pic d’activation plaquettaire peut être obtenu avec des concentrations d’héparine différentes mais toujours comprises entre 0,1 et
1 UI/mL d’héparine (9,34). De plus, la concentration optimale d’héparine peut varier d’un donneur de plaquettes à l’autre en raison d’une densité variable de F4P à la surface des plaquettes (35) et d’un effet inhibiteur FcγRIIa-dépendant des immunoglobulines endogènes sur l’activation induite par les anticorps de TIH (14).
Tableau 1 : Concentrations finales d’héparine utilisées selon le test fonctionnel et la matrice utilisés.
Table 1: Final heparin concentrations used depending on the functional test and matrix used.
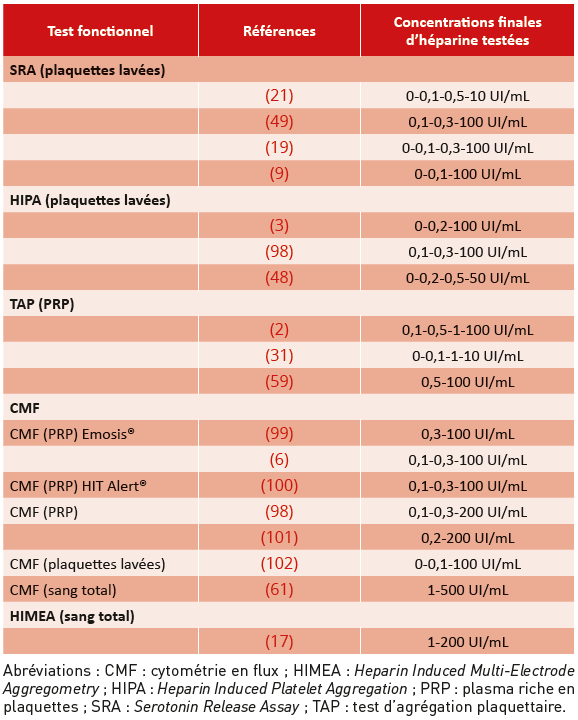
En théorie, la présence de protéines liant l’héparine dans le plasma pourrait expliquer que les tests réalisés sur le PRP ou sur sang total nécessitent des concentrations plus élevées d’héparine pour dissocier les complexes héparine/F4P que les tests sur plaquettes lavées. Malgré une importante variabilité selon les auteurs et les tests, les concentrations d’héparine supra-thérapeutiques utilisées sur sang total sont toutefois plus élevées que celles préconisées pour les tests sur PRP ou plaquettes lavées : respectivement 200 et 500 UI/mL versus 10 à 100 UI/mL.
Comme indiqué dans le tableau 1, la majeure partie des auteurs testent une condition sans héparine. Plusieurs travaux ont montré que certains plasmas ou sérums induisaient une activation plaquettaire en l’absence d’héparine mais celle-ci était toujours inhibée par une forte concentration d’héparine (19,36,37). Une activation plaquettaire observée en l’absence d’héparine n’est pas toujours due à la présence d’héparine résiduelle dans l’échantillon du patient, mais parfois à une fraction d’IgG anti-F4P (37). Ce profil d’activation plaquettaire peut être observé lors de TIH plus sévères, de survenue plus rapide sous héparine, ou encore sous fondaparinux (19). Ces anticorps peuvent également être responsables de TIH dites auto-immunes survenant en l’absence de traitement par héparine (38), avec une activation plaquettaire en SRA sans héparine. Ce profil atypique en SRA peut être dû à un titre élevé d’IgG anti-F4P/H, mais aussi à la présence d’anticorps IgG dirigés contre le F4P natif (36) qui sont retrouvés chez 30 % des patients avec une TIH (22,39). De plus, ce profil atypique est associé à un risque accru de thrombose (36) et pourrait contribuer à une thrombopénie plus sévère et persistante.
Existe-t-il des situations justifiant de tester l’effet d’autres molécules hépariniques ou de structure proche : enoxaparine, autre HBPM, ou danaparoïde sodique?
Proposition
– La recherche d’une réactivité croisée in vitro avec un autre glycosaminoglycane (GAG) n’est pas recommandée car il n’existe pas de corrélation avec une réaction croisée in vivo.
Rationnel
L’existence d’une réactivité croisée des anticorps de TIH avec les héparines de bas poids moléculaire (HBPM) est connue depuis longtemps (40). Des observations comparables ont été rapportées avec le danaparoïde sodique qui, comme les HBPM, est un glycosaminoglycane (GAG) d’origine naturelle (22,41,42). Le taux de réactivité croisée est cependant plus faible avec le danaparoïde sodique comparé aux HBPM (7 % vs 85 %) (43). Mais comme pour les HBPM, la réactivité croisée observée in vitro avec le danaparoïde sodique n’est pas systématiquement associée à une réactivité croisée in vivo (44).
Le test fonctionnel doit-il être réalisé avec du plasma ou du sérum ? Les échantillons doivent-ils êtres chauffés à 56 °C ?
Propositions
– Les tests fonctionnels peuvent être réalisés indifféremment en utilisant du plasma ou du sérum.
– Pour tous les tests fonctionnels, il est recommandé de chauffer le plasma ou le sérum à 56 °C pendant 30 minutes à 1 heure, puis de le centrifuger.
Rationnel
L’analyse de la littérature rapporte que le plasma et le sérum peuvent être testés indifféremment, quelle que soit la méthode utilisée.
Certains auteurs précisent que l’échantillon doit être préalablement chauffé à 56 °C pendant une durée comprise entre 30 minutes et 1 heure afin d’éliminer des traces résiduelles de thrombine, notamment dans le sérum, et dans une moindre proportion dans le plasma, qui pourraient induire une activation plaquettaire responsable d’un résultat faussement positif. Cette étape de chauffage est fréquemment mentionnée pour les tests réalisés avec des plaquettes lavées (SRA ou HIPA) mais semble moins utile lorsque les tests sont effectués sur PRP.
Un chauffage plus intense (63 °C pendant 20 min) conduit à l’apparition d’immuns complexes activateurs des plaquettes (19,45) et est donc à proscrire. Après chauffage, une centrifugation (8 000 à 12 000 g pendant 5 à 10 min ) permet d’éliminer la fibrine et les protéines précipitées.
Quelle place pour les échantillons-contrôles : CIQ et EEQ ?
Propositions
– Même si les donneurs sont sélectionnés, il est toujours nécessaire de vérifier la fonctionnalité des plaquettes lors de chaque série.
– Un CIQ doit systématiquement être réalisé lors de chaque série de tests.
– En l’absence de CIQ commercialisé, un échantillon de patients avec une TIH confirmée ou l’Ac 5B9 peuvent être utilisés comme contrôle positif.
– L’utilisation d’un agoniste plaquettaire indépendant de la voie FcgRIIA ne peut pas être testé comme CIQ pour évaluer la réactivité de plaquettes témoins vis-à-vis d’anticorps de TIH.
– En l’absence d’EEQ commercialisé, il est suggéré de participer régulièrement à un programme d’échange inter-
laboratoires (au minimum 1 fois par an).
– Lors de la réalisation par le laboratoire d’un programme d’échange inter-laboratoires à partir d’échantillons de patients :
o Il n’est pas conseillé de mélanger les échantillons de différents patients.
o Le nombre de cycles de congélation/décongélation des échantillons doit être limité afin d’éviter la formation d’agrégats d’IgG.
o Il est conseillé de choisir des échantillons prélevés lors de la phase aiguë afin de garantir un effet activateur maximal des anticorps.
o Il est conseillé de ne pas choisir d’échantillons de patients traités par immunoglobulines intraveineuses (IVIg).
Rationnel
Que les donneurs soient sélectionnés ou non, il est nécessaire de valider la fonctionnalité des plaquettes lors de chaque série de tests. La réactivité des plaquettes issues de donneurs est parfois vérifiée avec des agonistes plaquettaires tels que le collagène, l’ADP, l’acide arachidonique ou le peptide activateur du récepteur à la thrombine (TRAP), mais ces derniers n’explorent pas la voie d’activation dépendante de FcγRIIA (Tableau 2). Il est préférable de valider à la fois le système analytique et la fonctionnalité des plaquettes en utilisant un échantillon de patient avec une TIH confirmée ou l’anticorps 5B9.
Tableau 2 : Agonistes utilisés pour valider la fonctionnalité des plaquettes dans les tests fonctionnels.
Table 2: Agonists used in functional tests to validate platelet functionality.

Le CIQ permet de valider le système analytique et donc d’assurer la fiabilité des résultats. L’EEQ permet de comparer les résultats entre les laboratoires avec un échantillon de référence externe aux laboratoires. À ce jour, un EEQ utilisant l’anticorps 5B9 a été proposé.
Les CIQ, comme les EEQ, doivent se comporter comme un échantillon de patient et induire une activation plaquettaire en présence de faibles concentrations d’héparine, s’ils sont positifs. Cette activation doit être inhibée par la forte concentration d’héparine.
Une enquête nord-américaine réalisée auprès de 14 laboratoires réalisant les tests fonctionnels de diagnostic de TIH montre que 100 % des laboratoires utilisent un échantillon de TIH comme CIQ positif (33). Celui-ci est utilisé dilué ou non. Un CIQ négatif est également testé dans 93 % des cas et celui-ci peut être l’échantillon d’un sujet sain ou obtenu chez un patient pour lequel une TIH a été exclue (patient traité par héparine sans anticorps anti-F4P/H). Lors de l’étude internationale multicentrique réalisée avec l’anticorps 5B9, un échantillon de TIH dilué ou non avait été utilisé comme CIQ dans 9 cas sur 15 alors que le TRAP ou le collagène avaient été utilisés dans 3 cas. Aucun CIQ n’a été réalisé dans 3 des laboratoires participants (20).
Une seule étude réalisée par des laboratoires experts rapporte l’expérience d’un EEQ effectué à l’échelon international (Allemagne, Canada, Australie) en utilisant les sérums de patients ayant une TIH et un pool de sérum de sujets sains de groupe AB (46). Alors que les résultats de cet EEQ étaient conformes dans 97,6 % des cas pour les tests immunologiques, les résultats des tests fonctionnels (SRA, HIPA) étaient beaucoup moins bons, avec une concordance globale sur les échantillons de patients de 70 % ainsi que des résultats discordants en l’absence d’héparine mais également avec les échantillons positifs et négatifs. Une activation plaquettaire a même été observée par 4 laboratoires avec le contrôle négatif. Les auteurs recommandent de ne pas mélanger le sérum de plusieurs sujets, ce qui pourrait favoriser la formation d’agrégats d’IgG ou de complexes immuns. Une autre explication potentielle des discordances de résultats entre les tests fonctionnels pourrait être un nombre variable de cycles de congélation-décongélation effectués sur les échantillons de sérum. Ces résultats soulignent l’absence de standardisation des tests fonctionnels réalisés pour le diagnostic de TIH.
Enfin, un traitement des patients par IgIV peut également être à l’origine de faux négatifs avec les tests fonctionnels, ce traitement inhibant la fixation des immuns complexes formés avec les anticorps de TIH aux récepteurs FcgRIIA (28-30).
Quelles sont les performances comparées des différents tests d’activation plaquettaire ?
Il est relativement difficile de comparer les performances des différents tests en termes de sensibilité et de spécificité car le dessin des études et les critères de définition de la TIH ne sont pas toujours comparables. À ce jour, les deux méthodes considérées comme étant des méthodes de référence sont le SRA et le HIPA, même si moins d’études ont évalué les performances de ce dernier. L’une d’elles néanmoins retrouve une meilleure sensibilité du HIPA comparé au SRA, mais avec une moins bonne spécificité (agglutination passive des plaquettes sans libération du contenu des granules denses) (47). Plus récemment un travail français multicentrique sur 55 échantillons a montré une concordance de 83,8 % entre ces deux tests (48). Au cours du programme d’EEQ mentionné précédemment et restreint à un faible nombre de centres (n = 7) et dont seulement 1 centre ayant réalisé le SRA, les auteurs ont observé que le SRA n’était positif qu’avec seulement deux des cinq échantillons contenant des anticorps anti-F4P/H, tandis que le HIPA était positif avec quatre d’entre eux (46). Plus récemment, une étude multicentrique internationale réalisée avec l’anticorps 5B9 dans 11 centres différents – chaque centre devant tester les plaquettes de 10 donneurs – a montré une sensibilité très bonne et comparable des tests SRA, HIPA et HIMEA. La sensibilité des tests en CMF et en TAP était très variable selon les centres, soulignant le manque de standardisation de ces méthodes (20).
Quelle place pour les tests sensibilisés par ajout de F4P : pour quels patients ? Quelles concentrations de F4P ? Quelle origine du F4P ?
Propositions
– Un test fonctionnel avec ajout de F4P peut augmenter la sensibilité des tests réalisés sur plaquettes lavées.
– Le test fonctionnel sensibilisé (avec ajout de F4P) doit être réalisé dans les mêmes conditions que le test conventionnel.
– Ces tests sensibilisés sont réservés dans l’état actuel des connaissances aux patients ayant une forte probabilité de TIH avec un test immunologique positif (DO > 1) mais dont le test d’activation plaquettaire standard avec des plaquettes lavées est négatif (cf. Algorithme n° 2).
Rationnel
Le rapport stœchiométrique héparine/F4P est d’une importance majeure lors de l’activation plaquettaire induite par les anticorps de TIH. Les concentrations d’héparine dans le milieu réactionnel sont maîtrisées lors de la réalisation du test, alors que celles de FP4 à la surface des plaquettes, bien que critiques, sont probablement très variables d’un sujet à l’autre et selon le protocole de lavage des plaquettes utilisé.
En 2015, Nazy et al. ont montré pour la première fois que l’ajout de F4P dans le milieu réactionnel contenant les plaquettes lavées augmentait la sensibilité du SRA. Ils ont ainsi conclu que ce test sensibilisé pouvait détecter des anticorps cliniquement non pertinents, et dont l’augmentation du titre, associée à des conditions cliniques favorisantes, pourrait induire une TIH (49). En 2017, Vayne et al. ont également montré que le SRA sensibilisé par le F4P permet de détecter des anticorps pathogènes non mis en évidence par un test SRA classique (21). Cependant, l’ajout de F4P modifie le profil d’activation plaquettaire : une activation plaquettaire sans héparine peut être observée, mais celle-ci est totalement inhibée en présence d’une forte concentration d’héparine. Ces deux travaux montrent aussi que les échantillons positifs uniquement en SRA + F4P ont des DO plus faibles en ELISA que ceux positifs en SRA classique.
L’ajout de F4P a également été étudié en CMF, en mesurant l’expression de la P-sélectine. Dans ce test, l’effet de la faible concentration d’héparine n’est plus testé mais l’inhibition de l’activation plaquettaire avec une forte concentration d’héparine est recherchée (23).
À ce jour, les tests sensibilisés par le F4P sont peu standardisés et réalisés uniquement par des centres experts. L’origine et les concentrations du F4P sont variables d’une équipe à l’autre (Tableau S1, Annexes). De plus, ces tests sensibilisés sont très coûteux.
Les tests sur plaquettes autologues : est-ce utile et applicable en pratique ?
En pratique courante, les tests fonctionnels sont réalisés avec des plaquettes de sujets sains, puisque le patient est thrombopénique. L’utilisation des plaquettes du patient permettrait pourtant de s’affranchir de la nécessité des sujets témoins et le test refléterait mieux les conditions in vivo (2).
Les tests fonctionnels peuvent être réalisés sur les plaquettes du patient après normalisation de sa numération. En effet, l’augmentation du nombre de récepteurs FcYRIIa à la surface des plaquettes de patients atteints de TIH persiste bien au-delà de 2 semaines après le retrait de l’héparine et la normalisation de la NP. Ceci explique que les plaquettes autologues puissent être plus réactives aux échantillons issus de patients avec TIH. Une grande vigilance doit cependant être apportée aux autres traitements administrés et pouvant interférer sur les tests fonctionnels.
Les tests sur plaquettes lavées : sont-ils réservés aux centres experts ?
Propositions
– Le lavage des plaquettes est une procédure délicate qui doit être réalisée par un personnel expérimenté.
– Les étapes de remise en suspension doivent être douces.
– Le nombre important de protocoles disponibles nécessite que l’état d’activation des plaquettes après lavage soit vérifié lors de la mise au point de la méthode.
Rationnel
Les protocoles de lavage des plaquettes dans la littérature sont très variables (Tableau S2, Annexe). En effet, selon le protocole princeps, les plaquettes lavées sont fonctionnelles à condition qu’il y ait du calcium dans le tampon plaquettaire, une source d’énergie métabolique, et que l’accumulation d’ADP dans l’environnement plaquettaire ait été neutralisée. Aussi, l’apyrase qui dégrade l’ADP est largement utilisée (50). Cependant, d’autres équipes utilisent la prostaglandine PGE1 qui se lie au récepteur plaquettaire de la prostacycline, augmente l’activité de l’adénylyl-cyclase et les concentrations d’adénosine monophosphate (AMP) cyclique et inhibe ainsi l’activation plaquettaire.
Les autres détails techniques importants sont les suivants :
• Le tampon Tyrode est largement utilisé.
• L’hirudine peut être ajoutée au tampon Tyrode (test HIPA).
• L’anticoagulant sur lequel est effectué le prélèvement est l’ACD (acide citrique, citrate, dextrose).
Quelle méthodologie adopter pour la réalisation des tests d’activation plaquettaire réalisés en plaquettes lavées (tests HIPA et SRA) ?
Tests de libération de sérotonine radiomarquée (SRA)
Propositions
– Le SRA ne peut être mis en place que dans un laboratoire ayant un agrément pour l’utilisation de radioéléments.
– Deux faibles concentrations d’héparine doivent systématiquement être testées (concentrations finales comprises entre 0,1 et 1 UI/mL d’HNF), ainsi qu’une forte concentration (≥ 10 UI/mL).
– Il est pertinent de tester une condition sans héparine afin de détecter des anticorps particulièrement pathogènes (titres élevés et/ou spécificité anti-F4P).
– Un plasma/sérum d’un patient TIH positif ou un anticorps de TIH (tel que 5B9) doit être utilisé comme contrôle positif. Un échantillon négatif (ou plasma/sérum de sujet sain) doit être utilisé comme contrôle négatif.
– Un SRA est considéré positif si une activation plaquettaire > 20 % est observée en présence d’au moins l’une des 2 « faibles » concentrations d’héparine testées, avec une inhibition de plus de 50 % de l’activation maximale en présence de la forte concentration d’héparine.
Principe et performances
La sérotonine est un constituant physiologique des granules denses des plaquettes, et la mesure de la libération de sérotonine peut être utilisée pour quantifier l’activation plaquettaire induite par les anticorps de TIH présents dans le sérum ou le plasma du patient. La méthode a été décrite pour la première fois par Sheridan en 1986 (9).
Ce test est réalisé par un nombre limité de centres car il nécessite l’utilisation de plaquettes lavées comme pour le test HIPA, mais surtout la manipulation de radioéléments (carbone 14) soumis à une législation très stricte et dont l’utilisation est extrêmement coûteuse. Pour cette raison, il a été proposé d’évaluer la libération de sérotonine par chromatographie liquide à haute performance (45,51,52), ou plus récemment, par spectrométrie de masse (53).
Aujourd’hui, le SRA et le HIPA sont les deux tests considérés comme les tests de référence pour le diagnostic de la TIH (54).
Il est cependant important de noter qu’il n’existe pas de test de référence pour l’évaluation des performances du SRA, ce dernier étant considéré comme le plus sensible et spécifique. Le SRA présente de fait une excellente spécificité (90 à 100 %) et une bonne sensibilité (88 à 95 %) (55).
Une étude sur la variabilité des résultats du SRA, liée aux donneurs de plaquettes, a montré la possibilité de résultats faussement négatifs en présence de faibles concentrations d’anticorps ou de plaquettes de donneurs peu réactives (11). La sensibilité du SRA dans sa version standard a par la suite été remise en question par deux groupes indépendants (21,49) qui proposent de sensibiliser le test par l’ajout de F4P exogène humain dans le milieu réactionnel. En effet, la quantité de F4P à la surface des plaquettes est un paramètre critique pour la détection des anticorps de TIH (35) et les lavages plaquettaires réalisés au cours du SRA pourraient la réduire. Il est donc proposé, en cas de résultat douteux ou négatif en SRA standard, de refaire le test en ajoutant du F4P humain (10 µg/mL) aux plaquettes lavées afin de potentialiser la détection de plus faibles titres d’anticorps pathogènes.
Réalisation du SRA
Le SRA nécessite dans un premier temps l’incubation pendant 45 minutes à 37 °C de plaquettes issues de donneur (PRP) avec de la sérotonine radiomarquée au C14 (5-hydroxy-
14Ctryptamine, 50 mCi par µL de PRP). Les plaquettes sont ensuite lavées et incubées (numération ajustée à 300 G/L) pendant 1 heure à température ambiante en présence du plasma ou du sérum du patient préalablement chauffé (30 min à 56 °C) et de différentes concentrations d’héparine. Cette étape peut être réalisée en plaque ELISA ou en microgodets. Les volumes réactionnels préconisés sont : 75 µL de plaquettes, 20 µL de plasma ou sérum et 5 µL d’héparine non fractionnée (2 concentrations comprises entre 0,1 et 1 UI/mL et une forte concentration entre 10 et 100 UI/mL). La réaction est stoppée après ajout de PBS EDTA 0,5 % (250 µL). La plaque ELISA ou les godets sont ensuite centrifugés 5 min à 1 500 g pour sédimenter les plaquettes au fond des puits/tubes ; le surnageant (250 µL) est ensuite déposé dans du liquide de scintillation (2 mL). La radioactivité (RA) de chaque surnageant est ensuite mesurée à l’aide d’un compteur β à scintillation. Lors de chaque série, du triton 0,5 % x 100 est ajouté à un puits/godet ne contenant que des plaquettes radiomarquées afin d’évaluer la radioactivité maximale (RA Max) de la série. Un puits/godet où l’échantillon de patients est remplacé par du tampon sera également réalisé afin d’obtenir le bruit de fond de la série (RA BF).
Les résultats sont exprimés en pourcentage de libération de sérotonine pour chaque point, calculé de la façon suivante : % = [(RA Ech Patient – RA BF)/(RA max – RA BF)] x 100.
Contrôles et interprétation des résultats
Le test SRA est positif si une libération de sérotonine ≥ 20 % est objectivée en présence de faibles concentrations d’héparine et si une inhibition de plus de 50 % de l’activation maximale est mesurée en présence de la forte concentration d’héparine.
Une forte activation plaquettaire (> 50 % de libération de sérotonine) est observée dans les cas typiques en présence d’au moins une faible concentration d’héparine (56). Une activation plaquettaire en l’absence d’héparine peut aussi être observée en SRA comme avec d’autres tests fonctionnels de TIH, pouvant suggérer une plus forte pathogénicité des anticorps de TIH.
La procédure de lavage des plaquettes peut varier d’un laboratoire à l’autre, ce qui explique pourquoi certains exigent un seuil de 50 % pour considérer le résultat du test comme positif et d’autres un seuil de 20 % (9,19,31).
Un contrôle négatif ainsi qu’un échantillon de TIH bien caractérisé constituent les deux contrôles qui doivent systématiquement être testés. Le passage d’un échantillon faiblement positif est également recommandé afin d’évaluer la variabilité de réponse des plaquettes du donneur testé, celle-ci pouvant être due aussi à des facteurs techniques (19).
Tests d’activation des plaquettes induites à l’héparine (HIPA)
Propositions
– Le test HIPA est un test à lecture visuelle, celle-ci devant être réalisée par deux observateurs.
– Deux faibles concentrations d’héparine doivent systématiquement être testées (concentrations finales comprises entre 0,1 et 1 UI/mL d’HNF), ainsi qu’une forte concentration (50 ou 100 UI/mL).
– Il est pertinent de tester une condition sans héparine afin de détecter des anticorps particulièrement pathogènes (titres élevés et/ou spécificité particulière pour le F4P).
– Un plasma/sérum d’un patient TIH positif ou un anticorps de TIH (tel que 5B9) doit être utilisé comme contrôle positif. Un échantillon négatif (ou plasma/sérum de sujet sain) doit être utilisé comme contrôle négatif.
– Un test HIPA est considéré positif si une agrégation plaquettaire est observée en présence d’une faible concentration d’héparine, et inhibée en présence d’une forte concentration d’héparine ; ceci sur les plaquettes d’au moins 2 donneurs.
– Un test HIPA est considéré négatif si aucune agrégation plaquettaire n’est observée en présence d’une faible concentration d’héparine, ceci sur les plaquettes d’au moins 3 donneurs, quel que soit le degré de suspicion clinique.
Principe et performances
Le test HIPA est basé sur l’évaluation visuelle de l’agrégation plaquettaire dans des plaques 96 puits, sous agitation afin que les plaquettes restent en suspension dans le milieu réactionnel (plaquettes du donneur, sérum ou plasma du patient et héparine) (3,24,57). Les puits sont examinés visuellement toutes les 5 minutes avec une source de lumière indirecte. Un changement de turbidité du mélange réactionnel initialement complète (plaquettes non agrégées) jusqu’à obtention d’une transparence (plaquettes agrégées) est considéré comme un résultat positif.
Comparé au SRA, les performances du test HIPA sont très similaires (3,48) mais il demande moins de temps et surtout ne nécessite pas la manipulation de substances radioactives.
À l’instar de ce qui est fait en SRA et afin de sensibiliser le test, il est possible d’ajouter du F4P humain (10 µg/mL) aux plaquettes lavées afin de potentialiser la détection d’anticorps pathogènes lorsque leur titre est plus faible. L’ajout de F4P exogène dans le test HIPA ne doit cependant pas être systématique, mais réservé aux patients ayant des taux intermédiaires d’IgG anti-F4P/H (DO entre 1 et 2 en ELISA), une forte suspicion clinique de TIH et des résultats négatifs en HIPA conventionnel.
Réalisation du HIPA
Le HIPA nécessite une étape de lavage des plaquettes en présence d’hirudine et d’apyrase ou d’apyrase et de PGE1. Les plaquettes sont ensuite incubées (numération ajustée entre 300 et 400 G/L en tampon de réaction) pendant 45 minutes à 37 °C en présence de sérum ou de plasma citraté préalablement chauffé (30 à 45 minutes min à 56 °C) et d’héparine à plusieurs concentrations (0,2 et 100 UI/mL
dans le test princeps (3) ; 0,2-0,5 et 50 UI/mL dans la méthode adaptée (48)). L’incubation peut être effectuée dans des plaques ELISA (puits à fond plat ou à fond rond) en présence d’une bille magnétique (de type de celles utilisées avec un coagulomètre) et d’une agitation magnétique à 1 000 rpm ou mécanique sur un agitateur pour plaque. Les volumes réactionnels préconisés sont : 75 µL de plaquettes, 20 µL de plasma ou sérum et 10 µL d’héparine. La lecture peut être effectuée toutes les 5 minutes ou à un temps final de 25 minutes. Plus l’échantillon active les plaquettes, plus le temps nécessaire à l’obtention d’un résultat positif est court.
Contrôles et interprétation des résultats
Le test HIPA est considéré positif en cas d’éclaircissement du milieu réactionnel visible en présence de faibles concentrations d’héparine mais pas avec la forte concentration, sur au moins 2 donneurs de plaquettes différents.
Le test HIPA est considéré comme négatif en l’absence visible de variation de la turbidimétrie en présence de faibles concentrations d’héparine, avec au moins 3 donneurs de plaquettes.
Une activation plaquettaire en l’absence d’héparine peut aussi être observée en HIPA comme avec d’autres tests fonctionnels de TIH, pouvant suggérer une plus forte pathogénicité des anticorps de TIH.
Un contrôle négatif (tampon de réaction ou échantillon issu de contrôles sains ou de patients sous héparine sans thrombopénie) ainsi qu’un échantillon de TIH bien caractérisé sont deux contrôles qui doivent systématiquement être testés. L’utilisation d’un échantillon faiblement positif pour lequel une diminution de la turbidimétrie est observée à 25 minutes est également recommandée afin d’évaluer la variabilité de réponse des plaquettes de chaque donneur (19,57).
La lecture du test HIPA étant visuelle, elle doit être réalisée par 2 observateurs indépendants et formés à cette étape de lecture et d’interprétation des résultats.
Quelle méthodologie adopter pour la réalisation des tests d’activation plaquettaire réalisés en PRP (tests d’agrégation plaquettaire, cytométrie en flux) ?
Tests d’agrégation plaquettaire (TAP)
Propositions
– Deux concentrations faibles d’héparine doivent systématiquement être testées (concentrations finales comprises entre 0,5 et 1 UI/mL d’HNF), ainsi qu’une forte concentration (50 ou 100 UI/mL).
– Un plasma/sérum TIH positif connu ou un anticorps de TIH (tel que 5B9) doit être utilisé comme contrôle positif si l’échantillon testé est négatif.
– L’aspect sigmoïde de la courbe d’agrégation est indispensable pour conclure à une agrégation positive.
– Un TAP est considéré comme positif si une agrégation est observée en présence d’une faible concentration d’héparine avec au moins 1 donneur. Une inhibition de l’agrégation en présence d’une forte concentration d’héparine doit être aussi observée.
– Un échantillon négatif (ou plasma/sérum de sujet sain) doit toujours être testé comme contrôle négatif.
– Il est préférable de réaliser le TAP sur le PRP d’au moins 3 donneurs et avec une durée d’acquisition d’au moins 20 minutes avant de conclure à un résultat négatif.
Principe et performances
Le principe du TAP repose sur l’incubation en présence d’héparine du plasma ou du sérum du patient préalablement chauffé 30 min à 56 °C avec des plaquettes témoins.
La formation des agrégats plaquettaires entraîne une diminution de la turbidité objectivée par l’augmentation de la transmission lumineuse au travers de la suspension plaquettaire.
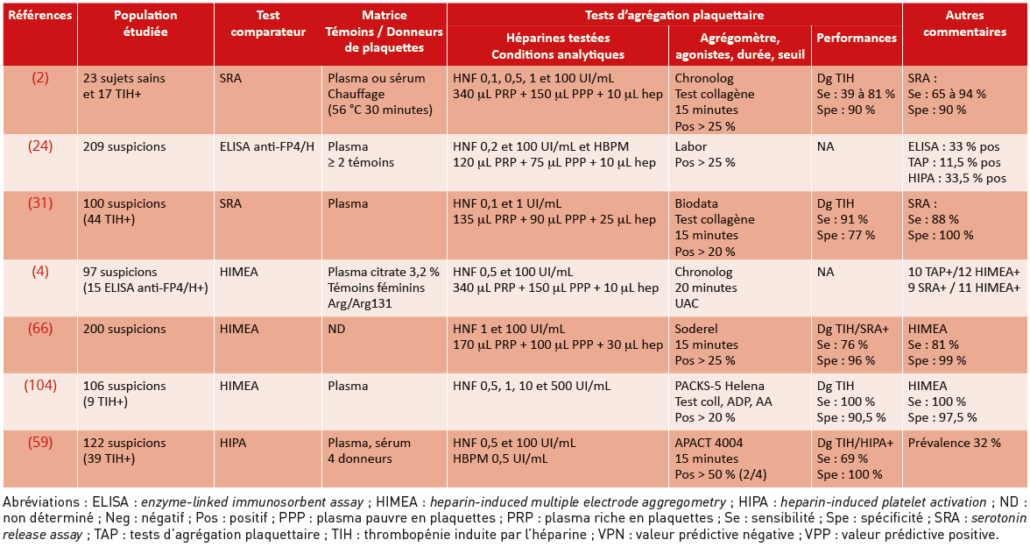
Les tests d’agrégation plaquettaire sont les tests fonctionnels les plus utilisés, du fait de la présence dans quasiment tous les laboratoires d’hémostase spécialisée d’agrégomètres dédiés à l’exploration des fonctions plaquettaires. La performance des TAP est satisfaisante à condition de bien sélectionner les plaquettes témoins et d’effectuer les contrôles appropriés : la sensibilité est de 69 à 91 % et la spécificité de 77 à 100 % selon les études (Tableau 3). Ces variations de performances peuvent être expliquées par l’utilisation de tests de référence différents d’une étude à l’autre et d’un nombre de cas de TIH positives très variable.
Réalisation des tests d’agrégation
La plupart des propositions pour l’accréditation des examens réalisés en agrégométrie optique pour l’exploration des fonctions plaquettaires peuvent être appliquées pour le TAP (58).
Tableau 3 : Caractéristiques et performances du test d’agrégation plaquettaire (TAP).
Table 3: Characteristics and performance of the platelet aggregation test (PAT).
Les explorations sont effectuées à l’aide d’un agrégomètre thermostaté à 37 °C, sous agitation constante (autour de 1 100 rpm). La préparation du PRP doit être effectuée selon les recommandations de l’ISTH (13). La numération plaquettaire du PRP témoin doit être vérifiée et doit être comprise entre 300 et 600 G/L. Il n’est pas recommandé d’ajuster les plaquettes du PRP témoin.
Selon les automates et les auteurs, les volumes réactionnels totaux varient entre 200 et 500 mL et les dilutions finales du plasma testé varient du demi au tiers. L’héparine est ajoutée sous un petit volume, le plus souvent compris entre 10 et 30 ml. La numération plaquettaire finale (après mélange du PRP témoin et du PPP patient) doit être au minimum de 150 G/L.
Au préalable, pour chacun des PRP témoins, il convient d’effectuer le réglage de l’agrégomètre :
– du point 100 % d’agrégation = PPP témoin + PPP patient ;
– du point 0 % d’agrégation = PRP témoin + PPP patient.
Les tests d’agrégation sont ensuite effectués en présence d’héparine non fractionnée à 2 concentrations comprises entre 0,5 et 1 UI/mL (concentration finale).
Une réponse positive est définie par la présence d’une nette cassure de la courbe, avec le plus souvent une agrégation maximale > 50 % (59). L’aspect sigmoïde de la courbe est caractéristique d’une réponse positive (Figure 2). Le délai de l’agrégation est variable et le temps de lecture doit être maintenu durant 15 à 20 minutes avant de conclure à une réponse négative.
Contrôles et interprétation des résultats
Pour valider les résultats du TAP, les échantillons de patients doivent être testés simultanément aux échantillons de contrôle (Tableau 4).
Vérification de la réactivité des plaquettes témoins :
La réactivité des plaquettes témoin doit être systématiquement vérifiée avec le plasma d’un patient TIH positif ou l’Ac 5B9, même si les donneurs sont connus comme étant bons répondeurs.
Si le test est négatif, un complément d’exploration doit être envisagé :
• Avec les plaquettes de 2 autres témoins sains.
En cas d’agrégation positive en présence de faibles concentrations d’héparine avec au moins l’un des témoins, il est nécessaire :
• de compléter le test en présence d’une forte concentration d’héparine (100 UI/mL) qui doit inhiber l’activation plaquettaire. En effet, une forte concentration d’héparine dissocie les complexes F4P/héparine (2,12) et si l’agrégation n’est pas inhibée par l’HNF à 100 UI/mL, le test n’est pas interprétable ;
• d’étudier la réponse en l’absence d’héparine (ajout de sérum physiologique au mélange PPP patient + PRP témoin). Une réponse positive sans héparine peut être expliquée :
o par la présence de thrombine (normalement inactivée par le chauffage préalable du plasma à 56 °C pendant 30 minutes) (2) ;
o par la présence d’héparine résiduelle dans le plasma du patient ;
o par des anticorps fortement activateurs (38).
Tableau 4 : Interprétation du test d’agrégation plaquettaire (TAP) selon les résultats obtenus avec les diff érentes concentrations d’héparine, sous réserve de contrôles conformes.
Table 4: Interpretation of the platelet aggregation test (PAT) according to the results obtained with the different concentrations of heparin, subject to compliant controls.
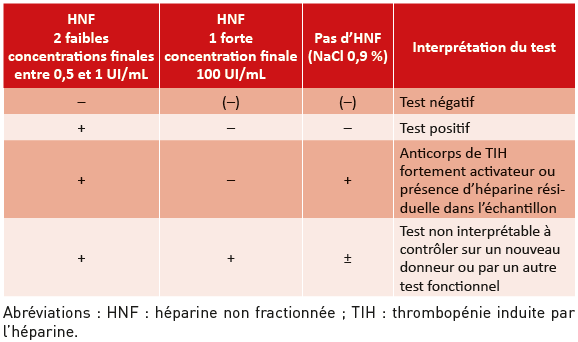
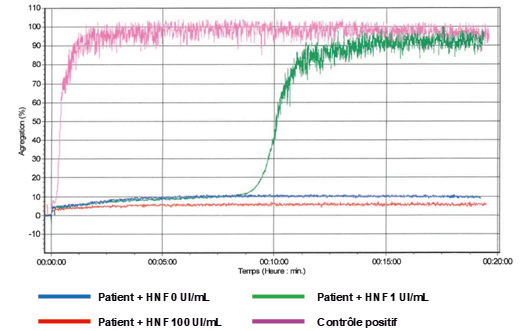
Figure 2 : Exemples de courbes obtenues avec le test d’agrégation plaquettaire (TAP).
Figure 2: Examples of curves obtained with the platelet aggregation test (PAT).
En cas de réponse positive en l’absence d’héparine, le diag-nostic de TIH reste possible si l’agrégation est inhibée par l’HNF 100 UI/mL.
• De confirmer ce résultat en utilisant les plaquettes d’un autre donneur.
Tests de cytométrie en flux (CMF)
Propositions
• Deux faibles concentrations d’héparine doivent systématiquement être testées (concentrations finales comprises entre 0,1 et 1 UI/mL d’HNF), ainsi qu’une forte concentration de 100 UI/mL.
• Il est pertinent de tester une condition sans héparine afin de détecter des anticorps particulièrement pathogènes (titres élevés et/ou spécificité particulière pour le F4P).
• Un plasma/sérum d’un patient TIH positif connu ou un anticorps de TIH (tel que 5B9) doit être utilisé comme contrôle positif. Un échantillon négatif (ou plasma/sérum de sujet sain) doit être utilisé comme contrôle négatif.
• Un test est considéré comme négatif si aucune activation plaquettaire n’est observée avec les plaquettes d’au moins 3 donneurs différents.
• Un test est considéré positif si, avec les plaquettes d’au moins 2 donneurs, une activation plaquettaire est observée en présence d’une faible concentration d’héparine et qu’elle est inhibée en présence d’une forte concentration d’héparine.
Principe et performances
La CMF évalue, comme les autres tests fonctionnels, la capacité du plasma (ou du sérum) d’un patient à activer, en présence d’héparine, les plaquettes d’un témoin. La CMF recherche une surexpression soit de la phosphatidylsérine en mesurant la fixation de l’annexine V, soit de la P-sélectine issue des granules α et exposée à la surface des plaquettes lors de leur activation (Tableau 5). Parallèlement aux marqueurs d’activation, les plaquettes sont identifiées avec un anticorps anti-CD41 dirigé contre la GPIIb plaquettaire.
Les performances des tests en CMF qui évaluent la fixation de l’annexine V varient, en termes de sensibilité et spécificité, respectivement de 88 à 95 % et de 96 à 100 %. Concernant les tests mesurant l’expression de la P-sélectine, leur sensibilité varie de 82 à 90 % et leur spécificité de 83 à 95 %. Comme pour les tests d’agrégation plaquettaire, les différences de performances des tests de CMF décrites dans la littérature peuvent être expliquées par des effectifs de TIH et des critères de sélection variables.
Dans une étude française réalisée sur 288 plasmas (131 TIH positives et 157 TIH négatives), la sensibilité du test basé sur la mesure de la P-sélectine était de 88 % et la spécificité de 95 %, ce qui est comparable aux performances du SRA réalisé parallèlement (Ss 88 % et Sp 97 %). Sur la base de cette étude, un test a temporairement été commercialisé
(Emo-test HIT Confirm®, Emosis, Illkirch-Graffenstaden, France), puis retiré du marché. Son évaluation avait de fait objectivé de moins bonnes performances, avec une sensibilité de 69 % et une spécificité de 75 % (60).
Un autre test en CMF, évaluant l’expression de la
phosphatidylsérine, a également été commercialisé (HIT AlertTM Kit, IQ Products, Groninge, The Netherlands) mais peu évalué.
Réalisation des tests
Les tests en CMF sont majoritairement réalisés sur du PRP qui doit être préparé selon les recommandations de l’ISTH (13). Deux équipes ont publié un test en CMF sur sang total (8,61) et une autre avec des plaquettes lavées (62). L’analyse est réalisée sur 10 000 à 100 000 événements selon les méthodes. La numération plaquettaire du PRP n’est pas mentionnée, car elle n’est pas un paramètre
critique en cytométrie. Les volumes de PRP analysés sont faibles et varient entre 10 et 70 mL. La plupart des protocoles utilisent 1 ou 2 faibles concentrations finales
d’héparine comprises entre 0,1 et 1 UI/mL et une forte de 100 UI/mL.
L’analyse en CMF nécessite un premier fenêtrage sur les plaquettes (CD41+) puis un second fenêtrage sur le marqueur d’activation en s’affranchissant des débris cellulaires.
Contrôles et interprétation des résultats
Un contrôle positif d’activation des plaquettes est testé dans la plupart des études. Il s’agit très souvent d’un ionophore calcique lorsque le marquage à l’annexine V est utilisé, ou du TRAP si le test mesure l’expression de la P-sélectine.
Comme pour les autres tests fonctionnels, la réactivité plaquettaire aux anticorps héparine-dépendants doit être évaluée en présence d’un plasma de TIH positif. Un test ne peut être conclu comme étant négatif qu’après avoir évalué la réponse d’au moins 3 PRP issus de donneurs différents.
L’absence d’activation spontanée des plaquettes doit être vérifiée sur un mélange PRP témoin et PPP témoin en présence d’une solution tampon.
Concernant l’interprétation des résultats, la majorité des équipes ont défini un pourcentage d’activation plaquettaire minimal à atteindre en présence de faibles concentrations d’héparine auquel s’ajoute un critère d’inhibition à une forte concentration d’héparine. Il est recommandé que chaque laboratoire définisse ses seuils.
Tableau 5 : Caractéristiques et performances des tests de CMF utilisés dans le diagnostic de TIH.
Table 5: Characteristics and performance of FCM tests used in the diagnosis of HIT.
Quelle méthodologie adopter pour la réalisation des tests d’activation plaquettaire réalisés sur sang total ?
Heparin Induced Multi Electrode Aggregometry (HIMEA)
Propositions
– Le sang total doit être laissé 30 minutes au repos avant utilisation.
– Le milieu réactionnel doit contenir une solution saline.
– Une concentration finale d’héparine de 1 UI/mL, ainsi qu’une forte concentration de 200 UI/mL doivent systématiquement être testées.
– Un plasma/sérum d’un patient TIH positif ou un anticorps de TIH (tel que 5B9) doivent être utilisés comme contrôle positif. Un échantillon négatif (ou plasma/sérum de sujet sain) doit être utilisé comme contrôle négatif.
– Il n’existe actuellement aucune recommandation sur le nombre de donneurs minimum à tester.
Principe et performances
Le test HIMEA ne peut être réalisé que dans un laboratoire possédant un Multiplate®, automate permettant l’étude de l’agrégation plaquettaire sur sang total par impédancemétrie. Il utilise des cuvettes qui possèdent deux jeux d’électrodes entre lesquelles passe un courant électrique qui sera modifié lorsque les plaquettes agrègent sur les électrodes.
Le sang total d’un donneur est déposé dans une cuvette et placé sous agitation continue à l’aide d’un barreau magnétique qui permet le maintien des plaquettes en suspension. Après ajout d’héparine à différentes concentrations et de l’échantillon du patient, les plaquettes, si elles agrègent, adhèrent sur les électrodes augmentant ainsi la résistance électrique. La modification du signal est traduite par une courbe d’impédance d’allure sigmoïdale similaire aux courbes d’agrégation plaquettaire du TAP. L’aire sous la courbe (AUC) est mesurée par l’automate.
Ce test présente l’avantage d’être réalisé sur sang total et Morel-Kopp et al. ont rapporté une amélioration des performances de l’HIMEA par rapport au test d’agrégation plaquettaire pour le diagnostic des TIH, avec des résultats comparables à ceux du SRA (63). Des résultats similaires ont été publiés par Jing Jin et al. avec une sensibilité de 85 % et une spécificité de 98 % de l’HIMEA et non différentes de celles du SRA (64). Il est à noter que dans cette étude, les mêmes donneurs ont été utilisés pour évaluer le test HIMEA et le SRA.
Réalisation du HIMEA
Le fabricant du Multiplate® préconise l’utilisation d’un sang prélevé sur hirudine (concentration finale de 25 µg/mL)
et cette recommandation a été reprise en 2016 par le sous-comité de l’ISTH. L’hirudine permet de maintenir les concentrations physiologiques en ions calcium et magnésium (65) et limite l’agrégation spontanée des plaquettes par inhibition de la thrombine. Deux études réalisées en 2012 et 2019 avec du sang prélevé sur citrate ont également permis de valider l’utilisation de cet anticoagulant (64,66).
Le sang du donneur doit être laissé au repos pendant 30 minutes avant d’être incubé avec l’échantillon du patient et l’héparine.
Les différentes méthodologies rapportées dans la littérature sont synthétisées dans le tableau 6. La dilution de l’héparine en solution saline et/ou l’apport d’une solution saline dans le milieu réactionnel constitue un point méthodologique important dans la mesure où les ions sont nécessaires au passage du courant électrique entre les électrodes.
Tableau 6 : Méthodologies proposées dans la littérature pour la réalisation du test HIMEA.
Table 6: Proposed protocols for the HIMEA test.
Toutes les expériences doivent être réalisées dans les 3 à 4 heures suivant le prélèvement et les changements d’impédance sont enregistrés pendant 15 à 30 minutes selon les auteurs. Les résultats sont exprimés sous forme d’aire sous la courbe (AUC) en utilisant des unités arbitraires.
Un temps de lecture variable sera à l’origine d’AUC différents, raison pour laquelle il appartient à chaque laboratoire de définir ses propres seuils.
Contrôles et interprétation des résultats
Selon les recommandations de l’ISTH (17), les résultats sont considérés comme positifs s’ils remplissent tous les critères suivants :
1/ une courbe d’allure parabolique (courbes rouge et bleue générées par chaque jeu d’électrodes, Figure 3) ;
2/ AUC (1 UI/mL d’HNF) > 30 AU ; ce seuil doit être défini dans chaque centre (sur la base des mesures effectuées sur 20 témoins sains et des patients non hospitalisés) ;
3/ AUC (200 UI/mL) < 50 % de l’AUC (1 UI/mL).
4/ AUC < 30 AU sans héparine (seuil à définir dans chaque centre). Attention, la présence d’anticorps de TIH hautement pathogènes ou d’héparine dans l’échantillon peut être responsable d’une AUC > 30 AU.
Il est important de redéfinir ces seuils lors de la mise au point de ce test car ils varient de façon importante selon les publications.
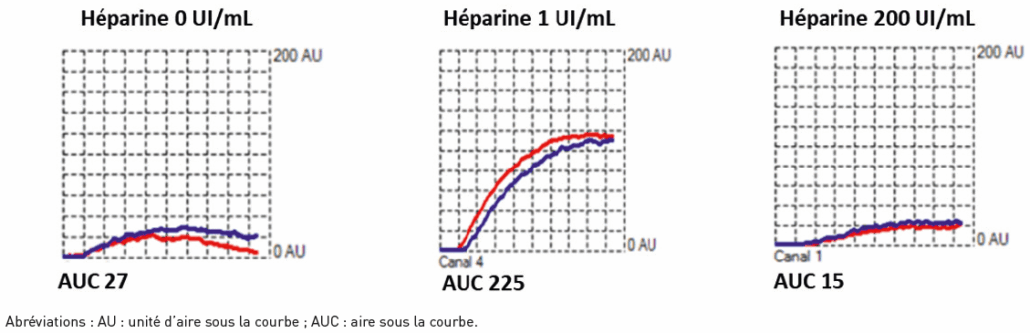
Figure 3 : Exemples de courbes obtenues avec le Heparin Induced Multi Electrode Aggregometry (HIMEA).
Figure 3: Examples of curves obtained with Heparin Induced Multi Electrode Aggregometry (HIMEA).
Stratégie diagnostique
Quelle stratégie diagnostique adopter hors chirurgie cardiaque/ECMO ?
Algorithmes décisionnels
La stratégie diagnostique recommandée en dehors de tout contexte de chirurgie cardiaque ou d’oxygénation extracorporelle (ECMO) est résumée dans l’Algorithme n° 1 (Figure 4).
Propositions
– Avant de rechercher la présence d’anticorps anti-F4P/H, il est recommandé d’évaluer la probabilité clinique de TIH (score 4T ou autre).
– En cas de probabilité clinique faible, il est recommandé de :
o Ne pas rechercher d’anticorps anti-F4P/H, sauf en cas de doute sur la fiabilité des renseignements cliniques obtenus. Le diagnostic de TIH est exclu, le traitement par héparine peut être poursuivi.
o Réévaluer la probabilité clinique en cas de nouvel événement clinique et/ou d’aggravation de la thrombopénie. Une vigilance particulière est recommandée dans un contexte de réanimation où les performances du score 4T sont moins bonnes.
– En cas de probabilité clinique intermédiaire, il est recommandé de réaliser la recherche d’anticorps anti-F4P/polyanion
(héparine ou PVS) par un test immunologique semi-quantitatif (ELISA, CLIA ou LIA) ou qualitatif (LFIA). Si le test est disponible dans la journée et :
o Si celui-ci est négatif, le diagnostic de TIH est exclu ; le traitement par héparine peut être poursuivi.
o Si celui-ci est positif, le diagnostic de TIH est probable ; il est alors recommandé de :
■ Évaluer les fonctions rénale et hépatique afin de décider de l’anticoagulant substitutif le plus adapté.
■ Congeler les prélèvements destinés au diagnostic biologique de la TIH avant la mise en route du traitement alternatif.
■ Rechercher des anticorps anti-F4P/H par un test immunologique semi-quantitatif (ELISA, CLIA ou LIA) si le test initial était un test qualitatif (LFIA).
■ Réaliser un test fonctionnel si le résultat du test semi-quantitatif est positif.
– En cas de probabilité clinique intermédiaire et si le test immunologique n’est pas disponible dans la journée il est recommandé de :
o Évaluer les fonctions rénale et hépatique afin de décider de la thérapeutique substitutive la plus adaptée.
o Congeler les prélèvements destinés au diagnostic biologique de la TIH avant la mise en route du traitement alternatif.
o Ne pas attendre les résultats de la recherche d’anticorps anti-F4P/H pour remplacer le traitement par héparine par un traitement anticoagulant alternatif.
o Rechercher des anticorps anti-F4P/H par un test immunologique semi-quantitatif.
o Réaliser un test fonctionnel si le résultat du test semi-quantitatif est positif.
– En cas de probabilité clinique forte, il est recommandé de :
o Évaluer les fonctions rénale et hépatique afin de décider de la thérapeutique substitutive la plus adaptée.
o Congeler les prélèvements destinés au diagnostic biologique de la TIH avant la mise en route du traitement anticoagulant alternatif.
o Ne pas attendre les résultats de la recherche d’anticorps anti-F4P/H pour remplacer le traitement par héparine par un traitement anticoagulant alternatif.
o Réaliser une recherche d’anticorps anti-F4P/H par un test immunologique semi-quantitatif et par un test fonctionnel.
– Si le test immunologique semi-quantitatif et le test fonctionnel sont positifs, le diagnostic de TIH est confirmé.
– Si le test immunologique semi-quantitatif et le test fonctionnel sont négatifs, il est nécessaire de ré-évaluer la probabilité clinique et/ou de refaire le test immunologique semi-quantitatif sur un nouveau prélèvement. Si celui-ci est toujours négatif, le diagnostic de TIH est exclu et le traitement par héparine peut être repris.
Quelle attitude adopter chez un patient avec des résultats de tests immunologiques et d’activation plaquettaire discordants ?
En cas de discordance entre le test immunologique et le test fonctionnel, suivre l’Algorithme n° 2 (Figure 5).
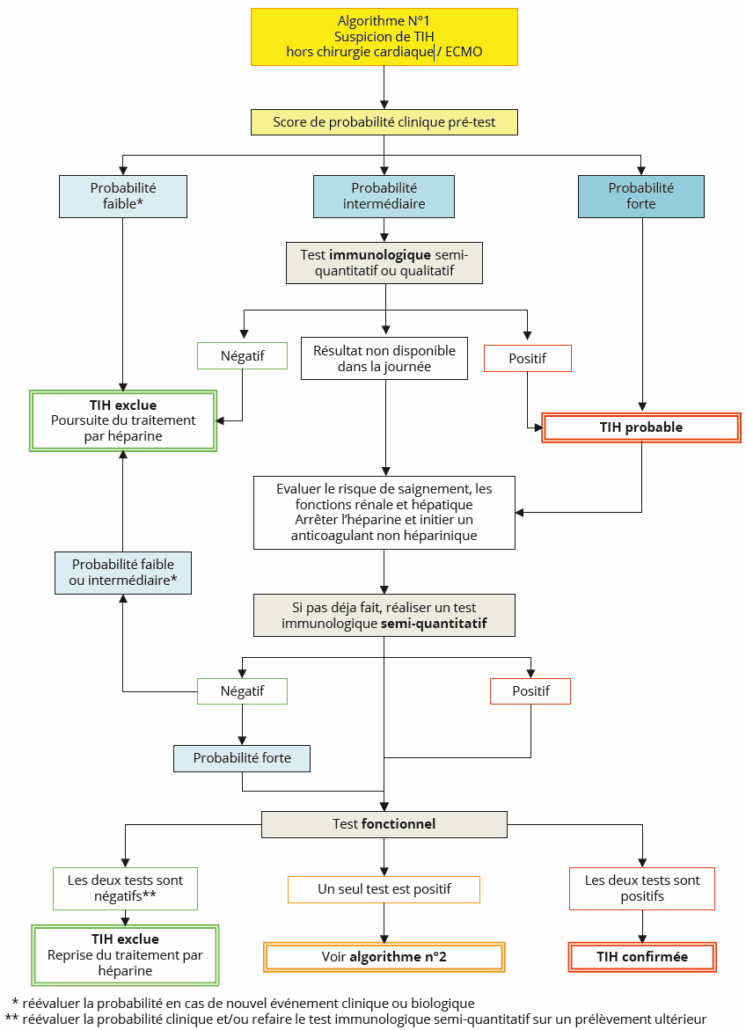
Figure 4 : Algorithme 1.
Figure 4: Algorithm 1.

Figure 5 : Algorithme 2.
Figure 5: Algorithm 2.
Propositions
– Si seul le test semi-quantitatif est positif (ELISA ou CLIA), le seuil de positivité guidera la conduite à tenir :
o En cas de résultat positif faible proche du seuil de positivité, le diagnostic de TIH est peu probable.
o En cas de résultat positif intermédiaire (ELISA DO entre 1 et 2 ou CLIA entre 2 et 10 UA), le diagnostic de TIH ne peut pas être affirmé. Il est proposé de ré-évaluer la probabilité clinique, de réaliser de nouveau un test fonctionnel en faisant varier les conditions analytiques (cf. Quelle méthodologie adopter pour la réalisation des tests d’activation plaquettaire réalisés en PRP (tests d’agrégation plaquettaire, cytométrie en flux) ?). Si un doute persiste, il est recommandé de contacter un centre expert, pour réaliser un autre type de test fonctionnel, notamment sensibilisé avec du F4P.
o En cas de résultat positif fort (ELISA DO > 2 ou CLIA > 10 UA), le diagnostic de TIH est très probable. Pour le confirmer, il est proposé de réévaluer la probabilité clinique, de réaliser de nouveau un test fonctionnel en faisant varier les conditions analytiques (cf. Quelle méthodologie adopter pour la réalisation des tests d’activation plaquettaire réalisés en PRP (tests d’agrégation plaquettaire, cytométrie en flux) ?). Si un doute persiste, il est recommandé de contacter un centre expert, pour réaliser un autre type de test fonctionnel, notamment sensibilisé avec du F4P.
– Si seul le test fonctionnel est positif, il est proposé de réaliser un autre test immunologique semi-quantitatif, ELISA de préférence.
o Si le test semi-quantitatif est positif (quelle que soit la valeur), le diagnostic de TIH est confirmé.
o Si le test semi-quantitatif est négatif, le diagnostic de TIH ne peut être exclu. Pour confirmer le diagnostic, il est proposé de ré-évaluer la probabilité clinique et de réaliser de nouveau le test fonctionnel. Si un doute persiste il est recommandé de contacter un centre expert, pour réaliser un autre type de test fonctionnel.
– Dans tous les cas où les tests biologiques sont discordants, une discussion pluridisciplinaire est recommandée afin de définir le niveau de probabilité du diagnostic de TIH et la prise en charge thérapeutique la plus adaptée.
Rationnel
Cas d’un test immunologique positif et d’un test fonctionnel négatif
En raison de la spécificité et la VPP faibles des tests immunologiques détectant les anticorps anti-F4P/H, un résultat positif doit être confirmé dans la plupart des cas par un test fonctionnel d’activation plaquettaire, réalisé de préférence avec des plaquettes lavées, pour une meilleure sensibilité (67). Néanmoins, dans certains cas hors chirurgie cardiaque et ECMO, le diagnostic de TIH peut être retenu en cas de forte positivité du test semi-quantitatif (68,69).
Si le test fonctionnel réalisé est négatif, le diagnostic de TIH est éliminé dans la plupart des cas. Cependant, si la probabilité clinique de TIH est élevée, il est utile de répéter le test fonctionnel avec un nouveau donneur et éventuellement avec une autre méthode. Des discordances ont ainsi été montrées entre le HIPA et le SRA (46).
Il a également été proposé de réaliser un test fonctionnel sensibilisé avec le F4P (cf. Quelle place pour les tests sensibilisés par ajout de F4P : pour quels patients ? Quelles concentrations de F4P ? Quelle origine du F4P ?), car cette procédure permet parfois de mettre en évidence des anticorps pathogènes non détectés par un test classique (21,49).
Cas d’un test immunologique négatif et d’un test fonctionnel positif
Dans ce cas, il convient, dans un premier temps, de vérifier si le test immunologique a été effectué en respectant la procédure, et de vérifier ce résultat négatif avec un autre test immunologique. Un test rapide négatif devra systématiquement être contrôlé par un test ELISA. En effet la VPN des tests immunologiques, et plus particulièrement des tests rapides, est très bonne mais n’est pas de 100 % (70,71).
Si le premier test immunologique est un ELISA, le résultat devra être contrôlé sur un prélèvement ultérieur et éventuellement avec une trousse qui utilise une cible antigénique différente (complexes F4P/H, F4P/PVS, lysat plaquettaire/H).
L’existence d’anticorps anti-IL8 et anti-NAP2 a été rapportée dans ce type de situations, mais leur pathogénicité n’est toujours pas démontrée (72-74). L’absence de test ELISA disponible pour rechercher ces anticorps est un facteur limitant important.
Quoi qu’il en soit, si une forte suspicion clinique existe, même en l’absence de test ELISA positif, il est nécessaire d’envisager le diagnostic de TIH et de traiter le patient en conséquence.
Quelles sont les bonnes pratiques d’utilisation du test rapide qualitatif (LFIA) dans cette stratégie diagnostique ?
Propositions
– Un test rapide qualitatif (LFIA) négatif permet d’exclure en urgence le diagnostic de TIH uniquement si la probabilité clinique est intermédiaire.
– En cas de doute sur la probabilité clinique (exemple : patients de réanimation), un test immunologique semi-quantitatif doit être réalisé.
– Devant une forte probabilité de TIH, il n’est pas recommandé de réaliser un test rapide qualitatif (LFIA) en raison du risque non négligeable de faux négatif dans ce contexte clinique. Si le test qualitatif est tout de même réalisé et négatif, la TIH ne peut être exclue.
– D’autre part, un test rapide qualitatif (LFIA) positif ne permet pas de confirmer le diagnostic de TIH. Il est recommandé de compléter l’exploration biologique par un test immunologique semi-quantitatif et par un test fonctionnel (si le test semi-quantitatif est positif).
Quelles sont les bonnes pratiques d’utilisation des tests immunologiques semi-quantitatifs dans cette stratégie diagnostique ?
Propositions
– Un test semi-quantitatif négatif permet d’exclure le diagnostic de TIH uniquement si la probabilité clinique est intermédiaire.
– En cas de probabilité clinique forte, un test semi-quantitatif négatif seul ne permet pas d’exclure une TIH. Il est recommandé de compléter l’exploration biologique par un test fonctionnel.
– En cas de probabilité élevée de TIH et dans l’impossibilité de réaliser un test fonctionnel dans l’immédiat, le diagnostic de TIH est très probable si le résultat du test semi-quantitatif est fortement positif (DO > 2 pour un ELISA anti-F4P/H IgG spécifique ou > 10 UA en CLIA). Un test fonctionnel est toutefois recommandé dans tous les cas pour confirmer le diagnostic.
Rationnel
Les tests immunologiques rapides sont de deux types : qualitatifs (immunochromatographie latérale sur membrane, LFIA) ou semi-quantitatifs (chimiluminescence – CLIA – et immunoturbidimétrie, LIA). Ces tests ont été validés pour leur bonne sensibilité et permettent, s’ils sont négatifs et en cas de probabilité faible ou intermédiaire, d’exclure le diagnostic de TIH en 30 à 60 minutes après l’arrivée du prélèvement au laboratoire. Combinés avec le score de probabilité clinique, ils sont donc d’excellents outils pour exclure rapidement une TIH en cas de probabilité intermédiaire. Néanmoins, leur spécificité n’est pas suffisante et, en cas de positivité, ils doivent toujours être associés à un test fonctionnel en fonction de la probabilité clinique
(cf. Algorithmes nos 1, 2 et 3) (70,71,75–77).
Les deux tests immunologiques rapides semi-quantitatifs disponibles à ce jour sont automatisés. L’un d’eux, réalisé sur l’automate ACL TOP®, repose sur une méthode d’immunoturbidimétrie avec compétition entre les anticorps de TIH du patient et un anticorps modèle de TIH (KKO) fixé sur des particules de latex (HemosIL® HIT Ab) (méthode LIA). Ce test manque de spécificité car il détecte toutes les classes d’anticorps anti-F4P/H. L’autre test rapide semi-quantitatif basé sur une méthode de chimiluminescence a été développé sur l’automate AcuStar (HemosIL® AcuStar HIT) (méthode CLIA). Point important : aucune corrélation n’a été mise en évidence entre l’amplitude du signal de chimiluminescence et le risque de TIH, mais un signal supérieur à 10 U/mL semble prédictif du diagnostic de TIH (71,78).
Ces nouveaux tests automatisés offrent plusieurs avantages comparativement aux tests ELISA : un délai plus court d’obtention des résultats et une réalisation unitaire, deux caractéristiques importantes pour un diagnostic d’urgence. Cependant, des automates dédiés sont nécessaires à leur réalisation et un test fonctionnel est a priori indispensable pour confirmer le diagnostic de TIH. Néanmoins, il a été montré récemment qu’en combinant les résultats obtenus en chimiluminescence et en immunofiltration sur gel (mais ce dernier test n’est plus commercialisé) (79) ou en immunoturbidimétrie (80), le diagnostic de TIH peut être affirmé avec une très forte probabilité lorsque les deux tests sont clairement positifs (LIA et CLIA > 5 U/mL).
Il est important de souligner qu’aucun test immunologique ne possède une sensibilité de 100 %, et notamment les tests rapides. Il est donc important de garder à l’esprit que, devant une forte suspicion de TIH (score 4T > 6) et un test rapide négatif (semi-quantitatif voire qualitatif), il convient de remplacer le traitement par héparine et de réaliser un test fonctionnel. Si le résultat du test fonctionnel est positif, un test immunologique semi-quantitatif de type ELISA IgG spécifique doit également être réalisé.
Quelle stratégie diagnostique adopter chez un patient après circulation extracorporelle ou sous ECMO ?
Recommandations générales
Propositions
– Il est recommandé de rechercher des anticorps IgG anti-F4P/H après CEC ou dans le contexte d’une assistance de type ECMO, en cas de chute de la numération plaquettaire après une remontée préalable (courbe biphasique), ou si une thrombopénie persiste au-delà de J5 après la CEC ou la pose d’ECMO.
– Il est recommandé de rechercher des anticorps IgG anti-F4P/H après CEC ou dans le contexte d’une assistance de type ECMO en cas de thrombose, quelle que soit l’évolution de la numération plaquettaire.
– Sous ECMO, il est proposé de rechercher systématiquement des anticorps IgG anti-FP4 en cas de thrombose inexpliquée et/ou de signes de dysfonctionnement du circuit
(« caillotage » avec dépôt de fibrine en excès dans le circuit).
– En raison de l’incidence élevée des anticorps anti-F4P non pathogènes après CEC ou pose d’ECMO, un test fonctionnel est nécessaire pour confirmer un diagnostic de TIH.
– Dans ce contexte spécifique et en l’absence de données de la littérature, l’utilisation du test rapide qualitatif (LFIA) n’est pas recommandée.
Propositions
– En cas de thrombose ou en cas d’absence de correction de la NP au-delà de J5 après CEC ou de majoration de la thrombopénie au-delà de J5 après la pose de l’ECMO, il est recommandé de rechercher des anticorps anti-F4P/H par un test immunologique semi-quantitatif. Si le résultat est obtenu dans la journée et :
o S’il est négatif, le diagnostic de TIH peut être exclu ; le traitement par héparine peut être poursuivi.
o S’il est positif, le diagnostic de TIH est probable ; il est alors recommandé de :
■ Évaluer le risque de saignement, les fonctions rénale et hépatique afin de décider de la thérapeutique substitutive.
■ Réaliser un test fonctionnel.
– En cas de discordance entre les deux tests, suivre l’Algorithme n° 2 (Figure 5).
– Si le test immunologique semi-quantitatif et le test fonctionnel sont positifs, le diagnostic de TIH est confirmé.
– En cas de thrombose isolée ou en cas d’absence de correction de la NP au-delà de J5 après CEC ou de majoration de la thrombopénie au-delà de J5 après l’ECMO, et si le test immunologique semi-quantitatif n’est pas disponible dans la journée, il est recommandé de :
o Congeler les prélèvements destinés au diagnostic biologique de la TIH avant la mise en route du traitement alternatif.
o Ne pas attendre les résultats de la recherche d’anticorps anti-F4P/H pour remplacer l’héparine par un anticoagulant alternatif non héparinique.
o Rechercher des anticorps anti-F4P/H par un test immunologique semi-quantitatif.
■ S’il est négatif, le diagnostic de TIH peut être exclu ; le traitement par héparine peut être poursuivi.
■ S’il est positif, le diagnostic de TIH est probable ; il est alors recommandé de réaliser un test fonctionnel.
– En cas d’allure biphasique de la cinétique plaquettaire après CEC, il est recommandé de :
o Congeler les prélèvements destinés au diagnostic biologique de la TIH avant la mise en route du traitement alternatif.
o Ne pas attendre les résultats de la recherche d’anticorps anti-F4P/H pour remplacer le traitement par héparine par un traitement anticoagulant alternatif.
o Évaluer le risque de saignement, les fonctions rénale et hépatique afin de décider de la thérapeutique substitutive.
o Réaliser une recherche d’anticorps anti-F4P/H par un test immunologique semi-quantitatif et par un test fonctionnel.
■ Si le test immunologique semi-quantitatif et le test fonctionnel sont négatifs, il est nécessaire de ré-évaluer la probabilité clinique et/ou de refaire le test immunologique semi-quantitatif sur un nouveau prélèvement. Si celui-ci est toujours négatif, le diagnostic de TIH est exclu et le traitement par héparine peut être repris.
■ En cas de discordance entre les deux tests, suivre l’Algorithme n° 2 (Figure 5).
■ Si le test immunologique semi-quantitatif et le test fonctionnel sont positifs, le diagnostic de TIH est confirmé.
Description
La stratégie diagnostique recommandée en contexte de CEC ou d’ECMO est résumée dans l’Algorithme n° 3 (Figure 6).
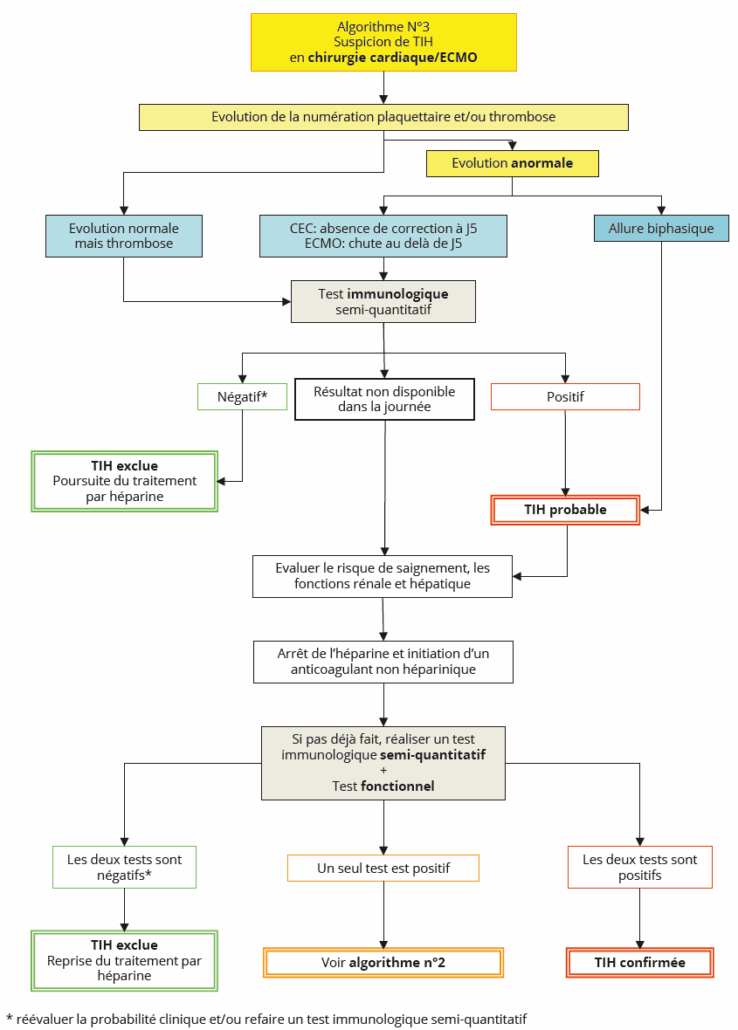
Figure 6 : Algorithme 3.
Figure 6: Algorithm 3.
Rationnel
Contexte de CEC
La TIH est une complication fréquente de la chirurgie cardiaque (1 à 3 %) en raison des fortes doses d’héparine administrées durant la CEC, laquelle induit par ailleurs une forte activation plaquettaire avec libération intra-
vasculaire de grandes quantités de F4P (81,82). Une thrombopénie au décours d’une CEC peut avoir de nombreuses origines, notamment l’hémodilution péri-opératoire et une consommation des plaquettes dans le circuit extracorporel. La thrombopénie est alors précoce, avant le 4e jour post-opératoire (J4) et se corrige spontanément. Dans tous les cas, une autre cause de thrombopénie, sepsis, coagulation intravasculaire disséminée (CIVD), autre médicament, doit être recherchée.
Dans ce contexte, le score des 4T est difficilement applicable. D’autres approches existent mais n’ont pas été validées, en particulier le score proposé par le groupe de travail GFHT-HIT (83) et l’HEP score (84,85). La cinétique plaquettaire est donc la plus évocatrice. Classiquement, une majoration de la thrombopénie à J5 après une CEC ou une nouvelle chute de la numération plaquettaire (86) doit faire suspecter une TIH. De plus, l’apparition d’une thrombose veineuse ou artérielle, ou d’une thrombose de valve cardiaque, associée à une non-correction de la numération des plaquettes est évocatrice d’une TIH. Une étude récente montre que si le patient a reçu un traitement prolongé par héparine dans les 10 jours précédant la CEC, la TIH peut survenir plus précocement dès J4 (87).
En raison de la prévalence importante des anticorps anti-F4P non pathogènes après chirurgie cardiaque, il est admis qu’une DO < 1 associée à un test d’activation plaquettaire négatif peut exclure une TIH dans ce contexte (88). De plus, une corrélation entre le titre d’anticorps IgG anti-F4P/H, reflété par la DO mesurée en ELISA et la probabilité post-test de TIH a été démontrée (56). Ainsi, la DO mesurée a une meilleure spécificité si elle est élevée (> 2) et un test immunologique semi-quantitatif de type ELISA est donc préférable. Toutefois, la présence d’anticorps anti-F4P/H ne permet pas à elle seule de confirmer le diagnostic de TIH qui devra donc être confirmé par des tests fonctionnels (86).
Si la recherche d’anticorps anti-F4P/H par un test immunologique est négative et que le test fonctionnel est positif, il est possible de rechercher des anticorps dirigés contre le sulfate de protamine injecté en fin de chirurgie cardiaque afin de neutraliser l’héparine. Dans ces cas, la thrombopénie peut être précoce après l’injection de sulfate de protamine au décours de la chirurgie cardiaque (89,90).
Contexte d’ECMO
Dans un contexte d’ECMO, le diagnostic de TIH est souvent compliqué par le fait que le circuit d’ECMO peut entraîner lui-même une thrombopénie par consommation des plaquettes. De plus, les patients sont souvent septiques avec des complications thrombotiques ou hémorragiques d’origine multifactorielle.
Dans une grande étude française portant sur 5 797 patients sous ECMO veino-artérielle (VA), il a été montré que la première cause de thrombopénie au décours de l’ECMO est médicamenteuse, avec de nombreuses molécules impliquées, y compris l’héparine (91). D’autres études portant sur un nombre plus faible de patients rapportent le développement d’IgG anti-F4P/H chez près de 30 % de cas sous ECMO et une TIH chez seulement 3 % d’entre eux (92-94).
Une thrombose du circuit d’ECMO ou la présence anormale de fibrine doit faire suspecter une TIH. Mais dans ce contexte particulier, le score des 4T est difficilement applicable et la présence d’anticorps anti-FP4/héparine ne permet pas à elle seule de confirmer le diagnostic de TIH qui devra donc être confirmé par des tests fonctionnels (93).
Sous ECMO et après CEC, des anticorps spécifiques IgG anti-F4P/H doivent préférentiellement être recherchés et non les IgA et IgM anti-FP4 qui sont peu ou non pathogènes et donc non spécifiques d’une TIH (95-97).
Dans tous les cas, une autre cause de thrombopénie doit être recherchée et en particulier la responsabilité d’un autre médicament (anti-infectieux, inhibiteur de la pompe à protons par exemple).
Liens d’intérêts : Yves GRUEL déclare avoir des liens d’intérêts avec Stago ; Christine MOUTON déclare avoir des liens d’intérêts avec Viatris ; les autres auteurs déclarent ne pas avoir de lien d’intérêt en rapport avec cet article.

