RÉSUMÉ
L’utilisation de l’héparine non fractionnée (HNF) est actuellement restreinte à des groupes spécifiques de patients, principalement en unité de soins intensifs ou en chirurgie cardiaque, qui sont le plus souvent en situation inflammatoire, avec un état d’hypercoagulabilité et un risque hémorragique élevé, ce qui rend leur prise en charge particulièrement difficile. Le terme « résistance à l’héparine » est utilisé de façon inappropriée pour définir une réponse insuffisante à l'HNF, qui s’explique par une pharmacocinétique et pharmacodynamique complexe du médicament. Dans la majorité des cas, ce phénomène est surmontable rapidement en utilisant des posologies ajustées au poids, en ayant recours à des bolus additionnels et en augmentant la dose d’HNF administrée pour atteindre l'intervalle thérapeutique cible selon des nomogrammes adaptés au poids. Le recours à un test anti-Xa doit être privilégié, car ce type de test n’est pas influencé par les facteurs affectant la mesure du TCA qui ne confèrent pas de risque hémorragique. Il n’existe aucune donnée probante démontrant le bénéfice clinique d’une supplémentation en antithrombine pour optimiser l’anticoagulation. Les données sur l’efficacité et la sécurité des inhibiteurs directs de la thrombine demeurent insuffisantes pour les proposer à la place de l’HNF, en dehors du traitement des thrombopénies induites par l’héparine.MOTS CLÉS
antithrombine, héparine non fractionnée, nomogramme, TCA, test anti-Xa
ABSTRACT
The use of unfractionated heparin (UFH) is currently restricted to specific patient groups, primarily in intensive care units or cardiac surgery, who are most often in an inflammatory state, with a hypercoagulable condition and a high risk of bleeding, making their management particularly challenging. The term "heparin resistance" is inappropriately used to describe an insufficient response to UFH, which is explained by the drug's complex pharmacokinetics and pharmacodynamics. In most cases, this phenomenon can be quickly overcome by using weight-adjusted dosages, administering additional boluses, and increasing the UFH dose to reach the target therapeutic range according to weight-based nomograms. The use of an anti-Xa assay should be favored, as this type of test is not influenced by factors affecting aPTT measurement, although they are not associated with a bleeding risk. There is no compelling evidence demonstrating the clinical benefit of antithrombin supplementation to optimize anticoagulation. Data on the efficacy and safety of direct thrombin inhibitors remain insufficient to recommend them as a substitute for UFH, except in the treatment of heparin-induced thrombocytopenia.
KEYWORDS
anti-Xa levels, antithrombine, aPTT, nomogram, unfractionated heparin
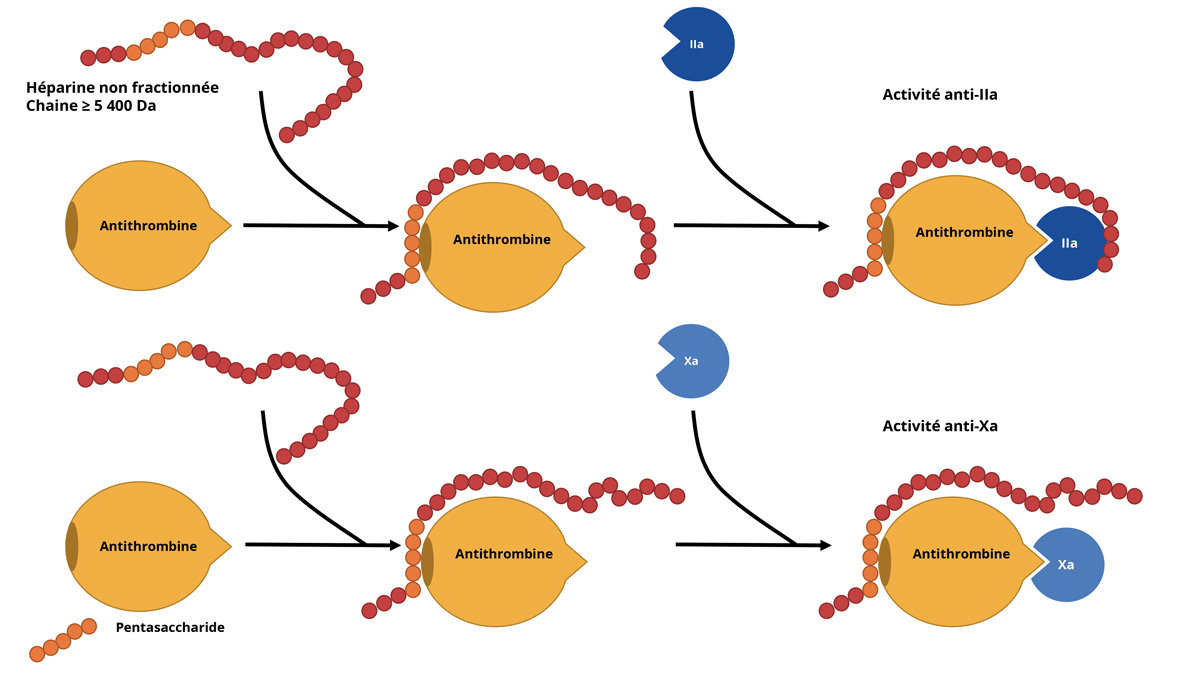
Figure 1: Anti-IIa and anti-Xa activity of unfractionated heparin.
L’effet inhibiteur de l’AT sur la thrombine (IIa) et le facteur Xa sont accélérés par l’héparine. Une longueur de chaîne minimale (≥ 18 unités saccharidiques incluant la séquence pentasaccharidique de forte affinité à l’AT ; ≥ 5 400 Da) est requise pour l’inhibition de la IIa qui nécessite une fixation de la chaîne sur l’antithrombine et sur la IIa, alors que les chaînes < 54 000 Da ne nécessitent pas de fixation sur le Xa.
Ces interactions avec de nombreuses protéines (environ une cinquantaine) et cellules de l’organisme (interactome) expliquent que la PK et la PD de l’HNF soient complexes, avec une grande variabilité inter- et intra-individuelle de réponse thérapeutique. Ainsi, un suivi de laboratoire de l’HNF prescrite à visée thérapeutique est recommandé, avec des tests répétés pour évaluer la réponse anticoagulante et ajuster la dose. La nécessité d’augmenter les doses peut s’expliquer par une neutralisation de l’HNF après liaison à des protéines autres que l’AT, dont le F4P. Le F4P peut être libéré in vivo, en cas d’activation plaquettaire, ou in vitro, lorsque les durées d’acheminement ou de prise en charge de l’échantillon sont longs.
CONDITIONS PRÉ-ANALYTIQUES
Des conditions pré-analytiques adéquates doivent impérativement être respectées pour le suivi biologique de l’HNF, selon les propositions de la Société française d’hémostase et thrombose (SFHT) : 1) le prélèvement doit être effectué avec comme anticoagulant le citrate de sodium (tubes à bouchon bleu) ; la concentration de citrate recommandée est de 3,2 % (0,109 M) ; 2) le prélèvement doit être effectué par ponction veineuse à distance du site de perfusion, au bras opposé à la perfusion, ou par une autre voie que celle utilisée pour l’administration ; 3) Les tubes doivent être bien remplis (remplissage recommandé ≥ 90 %, acceptable si ≥ 80 %, et inacceptable si < 80 %) afin de respecter le rapport anticoagulant/sang qui doit être de un volume d’anticoagulant pour neuf volumes de sang, un tube insuffisamment rempli pouvant induire un allongement artéfactuel du TCA ou, dans de rares cas, une sous-estimation du niveau d’anti-Xa (par dilution) ; 4) enfin, le temps écoulé entre le prélèvement et la réalisation des tests doit être au mieux de une à deux heures, et inférieur à quatre heures sous réserve d’une centrifugation dans l’heure suivant le prélèvement. Les conditions de conservation, de transport et de centrifugation peuvent
affecter les résultats, essentiellement en raison d’une possible neutralisation de l’héparine par le F4P libéré des plaquettes, pouvant induire une sous-estimation de l’activité anticoagulante de l’HNF.
Afin de prolonger le temps entre le prélèvement et la centrifugation pour le suivi de l’HNF, il est proposé que le prélèvement soit réalisé dans un tube contenant le mélange CTAD (citrate 0,109 M, théophylline, adénosine, dipyridamole), qui prévient l’activation in vitro des plaquettes et limite la libération P4F. Cependant cette attitude n’est pas consensuelle, et très peu de pays, en dehors de la France, ont accès aux tubes contenant le mélange CTAD (3).
TESTS UTILISÉS POUR LA SURVEILLANCE DE L’HNF
La surveillance de l’effet anticoagulant de l’héparine doit être réalisée six heures après le début de la perfusion, ou quatre à six heures après chaque changement de posologie en cas d’administration par voie intraveineuse en perfusion continue à la seringue électrique, ou à mi-chemin entre deux injections en cas d’administration par voie sous-cutanée.
En l’absence d’une approche, authentiquement intégrative (globale), validée et adaptée à la pratique clinique, la surveillance de l’HNF doit s’appuyer sur des tests de laboratoire réalisés avec du plasma pauvre en plaquettes, c’est-à-dire le TCA ou la mesure de l’activité anti-Xa. Les tests anti-Xa chromogéniques sont aujourd’hui considérés comme une meilleure option pour le suivi de l’HNF que le TCA, malgré l’absence de données solides de validation (4).
L’inconvénient du TCA est qu’il peut être affecté par de nombreuses conditions non liées à l’effet anticoagulant de l’HNF, ce qui est fréquent chez les patients en situation critique traités par HNF (Tableau 1). Il s’agit notamment des défauts du système contact de la coagulation, de l’interférence de la protéine C-réactive avec certains réactifs du TCA et de la présence d’un anticoagulant lupique, autant de conditions qui allongent le TCA. Un TCA de référence doit donc idéalement être mesuré avant le traitement par l’HNF afin de détecter un allongement non lié à l’anticoagulation. A l’inverse, des niveaux élevés de facteur VIII, fréquents dans les états inflammatoires, raccourcissent le TCA, le rendant moins sensible à l’HNF. Surtout, la sensibilité du TCA à l’HNF est très variable et dépend des réactifs (1). Par conséquent, l’utilisation du TCA pour surveiller l’HNF nécessite l’établissement d’une zone thérapeutique de l’HNF pour chaque réactif utilisé pour mesurer le TCA et chaque nouveau lot de réactifs. L’obtention d’un TCA avant l’instauration de l’HNF est indispensable, et s’il est prolongé ou raccourci, le TCA n’est pas adapté au suivi de l’HNF, et le recours à un test anti-Xa est la seule option.
La mesure de l’activité anti-Xa n’est pas spécifique de l’HNF, car elle peut être influencée par la présence de tout autre anticoagulant agissant sur le facteur Xa (FXa), ainsi que par les glycosaminoglycanes endogènes. Elle n’est pas impactée par les conditions cliniques affectant le TCA mais elle est néanmoins sujette aux mêmes contraintes pré-analytiques que le TCA et peut être influencée par les concentrations plasmatiques d’hémoglobine, de bilirubine et de lipides.
Actuellement, les dosages d’activité anti-Xa les plus largement utilisés (chromogéniques) reposent sur une méthode dite par compétition (le FXa et le substrat chromogénique étant ajoutés simultanément au plasma à étudier, il y a une compétition entre l’AT et le substrat chromogène pour la liaison à l’AT). Une concordance limitée entre les réactifs utilisés pour la mesure de l’activité anti-Xa HNF a été rapportée à plusieurs reprises avec des conséquences cliniques significatives (jusqu’à 46 % de modifications de la posologie) (5,6).
Une différence majeure entre les tests anti-Xa est la présence ou non de sulfate de dextran (DS) dans le réactif. Le DS est utilisé pour déplacer, au moins en partie, l’HNF du F4P libéré in vitro par les plaquettes dans le plasma après le prélèvement, afin de récupérer l’intégralité de l’HNF active. Le DS pourrait également déplacer l’HNF des complexes formés in vivo avec diverses protéines (interactome de l’héparine), contribuant ainsi à une surestimation des niveaux d’anti-Xa (5,7). Ceci est d’autant plus vrai après neutralisation de l’HNF par le sulfate de protamine, puisque le DS déplace aussi l’HNF du complexe HNF/protamine.
D’autres paramètres liés aux tests peuvent contribuer aux divergences des valeurs d’anti-Xa avec les tests compétitifs, notamment la dilution plasmatique, le rapport plasma/réactif, l’ajout éventuel d’AT exogène, le choix du calibrant ainsi que la méthode de traitement de la courbe d’étalonnage. La plupart des méthodes d’activité anti-Xa actuellement utilisées sont réalisées sans ajout d’AT exogène. Les tests avec AT exogène sont, par conception, insensibles aux variations du niveau d’AT endogène, masquant ainsi une diminution de la sensibilité à l’HNF, au moins partiellement liée à un déficit en AT.
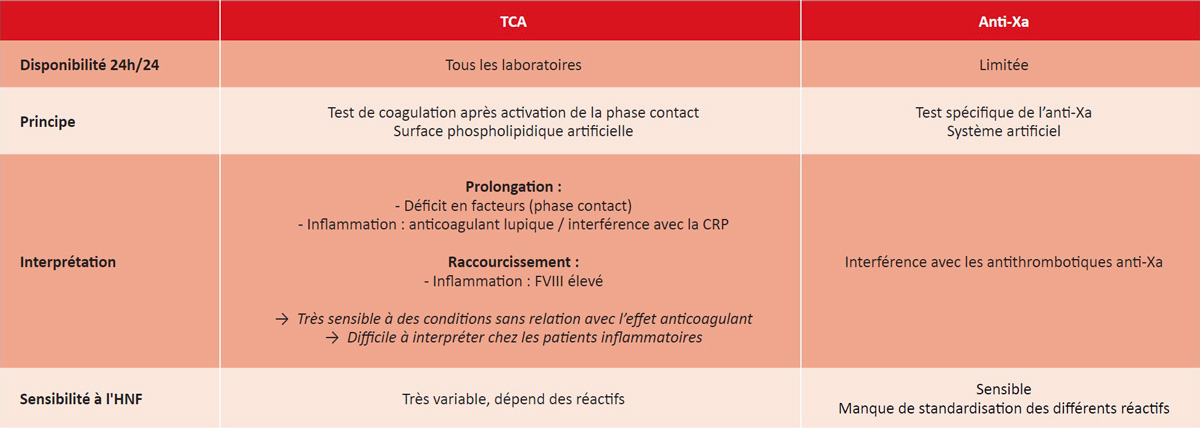
Tableau 1 : Principales caractéristiques du TCA et de l’anti-Xa pour le suivi du traitement par HNF.
Table 1: Main characteristics of TCA and anti-Xa for monitoring treatment with UFH.
CIBLES THÉRAPEUTIQUES
Dans les années 1970, une étude prospective a suggéré que l’obtention d’un TCA (réactif Dade Actin thromboplastin) compris entre 1,5 et 2,5 fois la valeur d’un pool de plasma normal pouvait réduire le risque de récidive thromboembolique veineuse chez les patients recevant de l’HNF pour le traitement d’un épisode aigu de maladie thromboembolique veineuse (MTEV). Sur la base de cette étude, un TCA rapport de 1,5 à 2,5 a longtemps été accepté comme intervalle thérapeutique de référence, sans qu’aucune autre étude prospective évaluant les résultats cliniques n’ait été réalisée (1). La zone thérapeutique a ensuite été exprimée en utilisant la titration à la protamine avec les valeurs de 0,2 à 0,4 U/mL correspondant à l’intervalle de TCA 1,5 à 2,5 fois la valeur témoin. Une seule étude, menée par le même groupe canadien, a soutenu le passage à l’activité anti-Xa. Des patients stables traités par HNF pour MTEV aiguë, et ayant présenté des TCA infra-thérapeutiques dans les 24 heures précédant la randomisation ont été inclus. Les patients ont été randomisés en deux groupes, dans lesquels les doses d’HNF étaient adaptées en fonction du résultat, soit de la mesure de l’activité anti-Xa (Stachrom
Heparin, Stago) pour une cible comprise entre 0,30 et 0,67mL, soit du « TCA » (Actin FS, Dade) pour une cible comprise entre 60 et 85 secondes ; cibles correspondant à la zone thérapeutique en titration de protamine de 0,2 à 0,4 U/mL. Les quantités moyennes d’HNF administrées au cours des quatre premiers jours suivant la randomisation ont été significativement plus élevées dans le groupe « TCA » que dans le groupe « anti-Xa ». Depuis lors, une cible arrondie de 0,30-0,70 U/mL d’anti-Xa a été largement acceptée comme l’intervalle thérapeutique à atteindre chez les patients recevant de l’HNF pour traiter une MTEV aiguë, sans qu’aucune étude prospective supplémentaire n’ait remis en cause cet intervalle (8). Pour les autres indications, les cibles thérapeutiques sont le plus souvent empiriques, non consensuelles et ne reposent sur aucune étude clinique.
NOTION DE « RÉSISTANCE À L’HÉPARINE »
Stricto sensu, l’expression « résistance à l’héparine » implique que l’héparine ne parvient pas à agir sur sa cible (l’antithrombine), indépendamment des variations pharmacocinétiques et pharmacodynamiques. Ce type de résistance pourrait s’observer en cas de déficit constitutionnel qualitatif en antithrombine de type II Heparin Binding Site (HBS) homozygote (antithrombine Budapest 3). Dans ces cas particuliers, une supplémentation en antithrombine peut être envisagée pour obtenir l’anticoagulation souhaitée. Certaines variations de séquence de la thrombine (prothrombine Yukuhashi, prothrombine Belgrade et prothrombine Padoue) sont associées à une résistance à l’antithrombine (et donc à une authentique résistance à l’héparine) et à une augmentation du risque de MTEV. Ces causes de résistance génétique sont cependant exceptionnellement rencontrées (1).
De surcroît, et sans surprise, il n’y a pas de consensus concernant le seuil qui permet de définir une dose d’HNF « anormalement élevée », ni concernant l’intervalle thérapeutique à atteindre, ce dernier pouvant varier en fonction de l’indication, du test biologique utilisé (mesure de l’activité anti-Xa ou TCA) et du couple automate/réactif propre à chaque laboratoire. Aussi l’utilisation de l’expression, altération de la réponse à l’héparine, semble être plus adaptée. Pour le traitement de la MTEV à la phase aiguë, une posologie > 35 000 UI d’HNF/jour ne permettant pas d’atteindre une cible d’activité anti-Xa comprise entre 0,30 et 0,70 UI/mL a été considérée comme « anormalement élevée ». Cette définition correspond à celle adoptée par Levine et coll. dans leur étude précédemment citée (8). Ce seuil a par la suite été largement utilisé dans la littérature pour définir la résistance à l’héparine, sans n’avoir jamais été réellement remis en question
QUE FAIRE EN CAS « D’ALTÉRATION DE LA RÉPONSE À L’HÉPARINE » ?
Il est cliniquement important d’atteindre rapidement des niveaux thérapeutiques d’HNF dans les 24 heures, en particulier en cas de MTEV aiguë. Une surveillance appropriée avec des ajustements rapides de la dose selon un nomogramme adapté au poids permet souvent de résoudre ce problème. Cela est particulièrement vrai lorsque le traitement est guidé par un test anti-Xa (1,3).
Parmi les variables qui influencent la réponse individuelle à l’HNF, le poids joue un rôle prépondérant. Par ailleurs, la neutralisation de l’HNF, par liaison à « l’interactome » et aux surfaces artificielles, nécessite des augmentations de dose pour atteindre la cible thérapeutique dans des
situations inflammatoires ou spécifiques.
En 1993, Raschke et coll. ont démontré, dans un essai contrôlé randomisé, que des ajustements posologiques basés sur le poids, incluant un bolus initial (afin de saturer la liaison de l’HNF aux protéines autres qu’à l’AT) et des bolus répétés si nécessaire (pour surmonter la neutralisation de l’HNF), permettaient qu’une proportion significativement plus élevée de patients atteigne l’intervalle thérapeutique cible du TCA en moins de 24 heures, comparé à une stratégie d’adaptation standard (9). De plus, les récidives étaient plus fréquentes dans le groupe recevant des soins standards. Par la suite, plusieurs études ont démontré l’intérêt des nomogrammes adaptés au poids, dérivés de celui de Raschke et coll., notamment ceux basés sur les niveaux d’anti-Xa, pour atteindre plus rapidement le seuil thérapeutique et avec moins d’ajustements posologiques sur une période de 24 heures. Toutefois, leur
bénéfice sur les résultats cliniques n’a pas été démontré.
Ces nomogrammes, qui proposent tous un bolus initial, diffèrent quant à la dose du bolus, la dose initialement administrée en perfusion continue, ou l’administration de bolus supplémentaires (10-12).
Les déficits acquis en AT, observés dans de nombreux contextes cliniques (phase aiguë de la thrombose,
insuffisance hépato-cellulaire, coagulation intravasculaire disséminée, consommation en cas de circulation extra-corporelle, syndrome néphrotique, traitement par L-asparaginase…) sont classiquement évoqués comme une cause potentielle de mauvaise réponse à l’héparine.
Cependant, le niveau plasmatique d’AT nécessaire pour obtenir l’effet anticoagulant souhaité de l’HNF n’est ni connu ni établi, et dépend probablement de l’état clinique du patient. Par ailleurs, l’augmentation des doses d’HNF à l’aide d’un nomogramme basé sur le poids pourrait compenser la réponse diminuée à l’HNF liée à une baisse du niveau d’AT. Bien que l’administration d’AT puisse améliorer l’anticoagulation en modifiant la réponse dose-effet, aucun bénéfice clinique de cette approche n’a été démontré. Les études disponibles sur l’administration d’AT pour la plupart concernent la chirurgie cardiaque, et montrent que l’administration d’AT améliore l’effet anticoagulant de l’héparine mesuré par le temps de coagulation activé (ACT). Cependant, les essais randomisés n’ont pas mis en
évidence de bénéfice de l’administration d’AT sur le pronostic, tout en rapportant une augmentation du risque de saignement ou d’insuffisance rénale aiguë. Dans le cadre de l’ECMO veino-artérielle, une diminution acquise de l’AT est décrite et peut persister pendant les 72 premières heures, sans corrélation avec la réponse à l’HNF. De plus, chez les patients adultes sous ECMO veno-veineuse, l’administration d’AT n’a pas permis de réduire les besoins en HNF ni l’incidence des événements hémorragiques et/ou thrombotiques (1,3).
Certains auteurs ont suggéré de recourir aux inhibiteurs directs de la thrombine (argatroban ou bivalirudine) en cas de « résistance à l’héparine ». Néanmoins, les données sur l’efficacité et la sécurité de cette classe d’anticoagulants demeurent insuffisantes pour les proposer comme alternative dans ce contexte clinique, en dehors des cas de thrombopénie induite par l’héparine.
En pratique, en cas de difficulté à atteindre l’intervalle thérapeutique ciblé malgré l’augmentation des doses d’HNF, nous suggérons d’adopter une approche systématisée et séquentielle, dont les étapes sont résumées dans la figure 2.
Par conséquent, lorsqu’un niveau thérapeutique n’est pas atteint ou que les doses d’HNF sont jugées excessivement élevées, avant d’envisager une action telle que l’ajout d’antithrombine ou le recours à un inhibiteur direct de la thrombine, un examen attentif du cas est nécessaire (Figure 2). L’analyse systématique en cas de réponse insuffisante selon les tests de laboratoire pour mesurer l’effet anticoagulant de l’HNF doit inclure des actions coordonnées entre les cliniciens, les infirmiers et les responsables de l’hémostase de laboratoire afin de : i/ s’assurer de la minimisation de la libération de F4P par les plaquettes dans les tubes de prélèvement ; ii/ vérifier que le médicament est correctement administré (erreurs de préparation, vitesse de perfusion inappropriée, problème d’accès vasculaire, administration concomitante de médicaments dans la même ligne) ; iii/ être conscient des interférences analytiques possibles ; iv/ prendre en compte les caractéristiques du patient (âge, état inflammatoire) ; v/ garantir une utilisation appropriée de l’HNF : ajustement posologique selon un nomogramme adapté au poids (bolus à l’initiation – ajustements de dose, avec bolus supplémentaires si nécessaire – surveillance biologique selon le nomogramme) ; vi/ envisager une thrombopénie induite par l’héparine (TIH), en particulier en cas d’échec clinique associé au traitement par HNF.
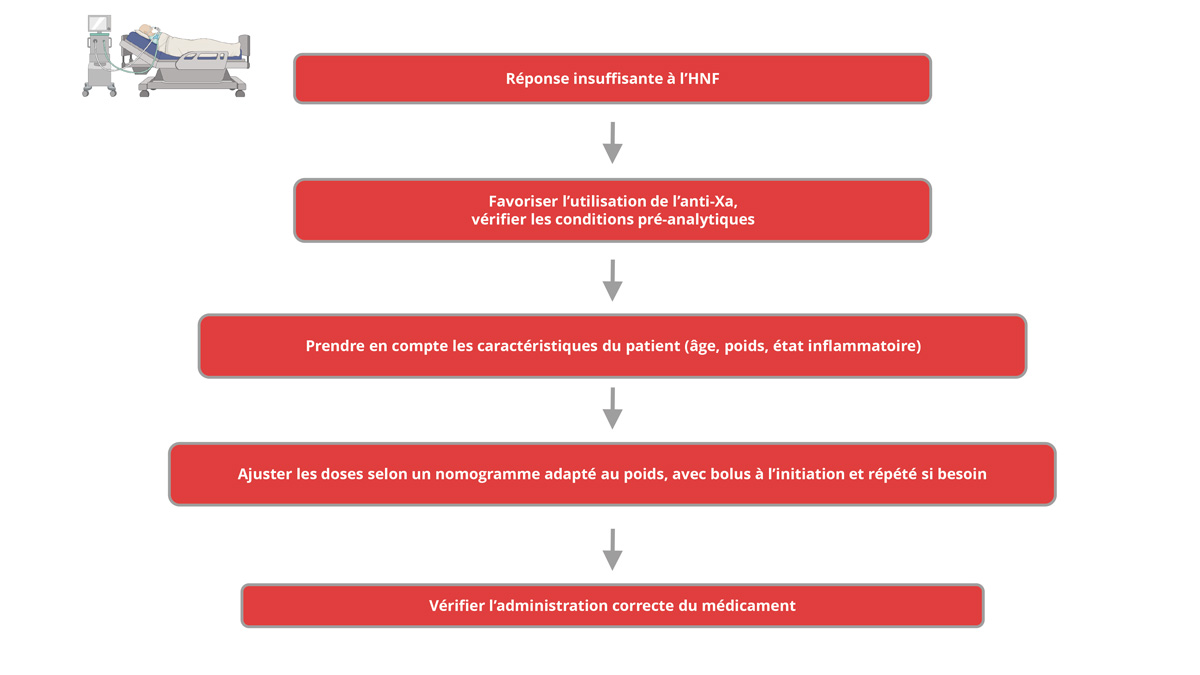
Figure 2 : Attitude en cas de réponse insuffisante selon les tests de laboratoire, pour mesurer l’effet anticoagulant de l’HNF.
Figure 2: Action to be taken in case of insufficient response according to laboratory tests measuring the anticoagulant effect of UFH.
CONCLUSION
Le terme « résistance à l’héparine » est utilisé le plus souvent de façon inappropriée pour définir une réponse insuffisante à l’HNF, qui s’explique par une PK et PD complexe du médicament. Dans la majorité des cas, ce phénomène est surmontable rapidement en utilisant des posologies ajustées au poids, en ayant recours à des bolus additionnels et en augmentant la dose d’HNF administrée pour atteindre l’intervalle thérapeutique cible. Une analyse systématisée des facteurs pouvant contribuer à une mauvaise réponse à l’HNF doit être entreprise. Le recours à un test anti-Xa doit être privilégié, car ce type de test n’est pas influencé par les facteurs affectant la mesure du TCA qui ne confèrent pas de risque hémorragique. L’utilisation de nomogrammes adaptés au poids, permet, dans la plupart des cas, d’atteindre rapidement l’anticoagulation souhaitée. Il n’existe aucune donnée probante démontrant le bénéfice clinique d’une supplémentation en antithrombine en cas de mauvaise réponse à l’héparine. Les données sur l’efficacité et la sécurité des inhibiteurs directs de la thrombine demeurent insuffisantes pour les proposer comme alternative à l’HNF dans ce contexte clinique.
POINTS CLÉS À RETENIR
• L’utilisation de l’HNF est actuellement restreinte à des patients en situation critique, le plus souvent
inflammatoires.
• Chez ces patients la mesure de l’anti-Xa est préférée au TCA, pour l’adaptation des doses d’HNF.
• Le terme « résistance à l’héparine » est utilisé de façon inappropriée pour définir une réponse insuffisante à l’HNF liée à sa PK et sa PD complexes.
• La réponse insuffisante à l’HNF est surmontable en utilisant des nomogrammes adaptés au poids avec bolus.
• Aucune donnée n’a démontré le bénéfice clinique d’une supplémentation en antithrombine pour optimiser l’anticoagulation.

