INTRODUCTION
Les maladies hépatiques associées à une dysfonction métabolique (Metabolic dysfunction–associated steatotic liver disease, MASLD) représentent un enjeu majeur de santé publique, avec une prévalence mondiale estimée à près de 38 %, en lien avec la prévalence croissante de l’obésité et du diabète de type 2 (1). Ce spectre s’étend de la stéatose simple à des formes avancées comme la Metabolic Associated Steatosis Hepatitis (MASH), la cirrhose et le carcinome hépatocellulaire. La progression vers la MASH concerne 12 à 40 % des patients atteints de MASLD, en particulier en cas d’obésité viscérale ou de diabète (1). En l’absence de traitement médicamenteux validé, la perte de poids constitue l’approche thérapeutique de référence. La chirurgie bariatrique peut être envisagée dans les cas d’obésité les plus sévères. La transplantation hépatique, ultime recours, est de plus en plus indiquée, y compris en l’absence de cirrhose, notamment en cas de décompensation métabolique ou de carcinome hépatocellulaire.
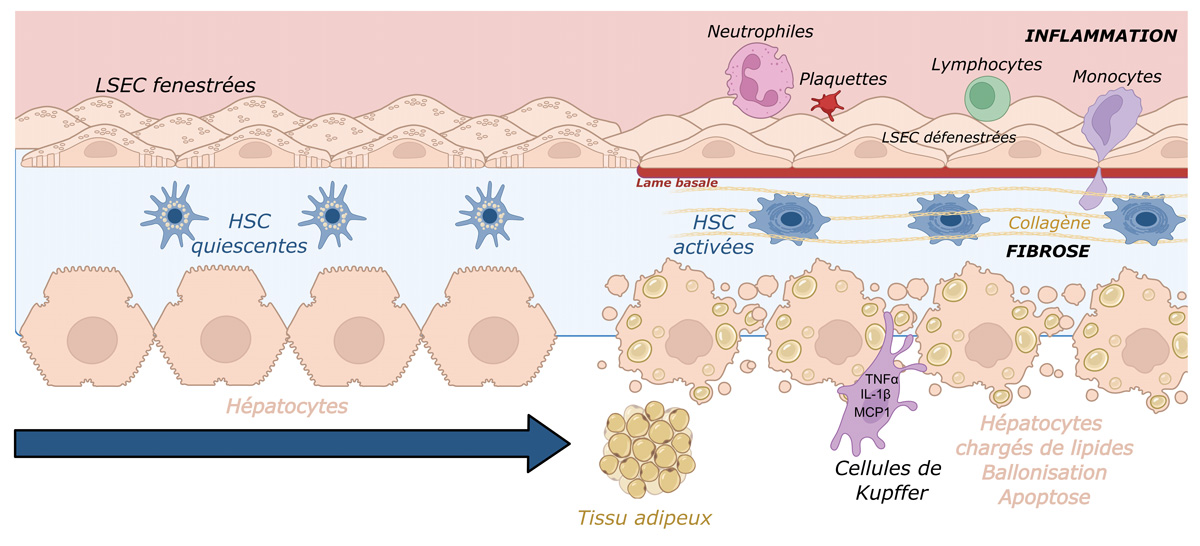
Au niveau cellulaire, le développement des MASLD repose sur des interactions complexes impliquant divers types cellulaires hépatiques et extra-hépatiques : les hépatocytes, les adipocytes, les cellules immunitaires (circulantes ou résidentes du tissu, notamment les cellules de Kupffer), les cellules endothéliales sinusoïdales (Liver Sinusoidal Endothelial Cells, LSEC) et les cellules stellaires hépatiques (Hepatic Stellate Cells, HSC). Les signaux lipotoxiques issus du tissu adipeux, le stress oxydatif et l’inflammation orchestrent une cascade aboutissant à la fibrose et au remodelage du tissu hépatique (2) (Figure 1).
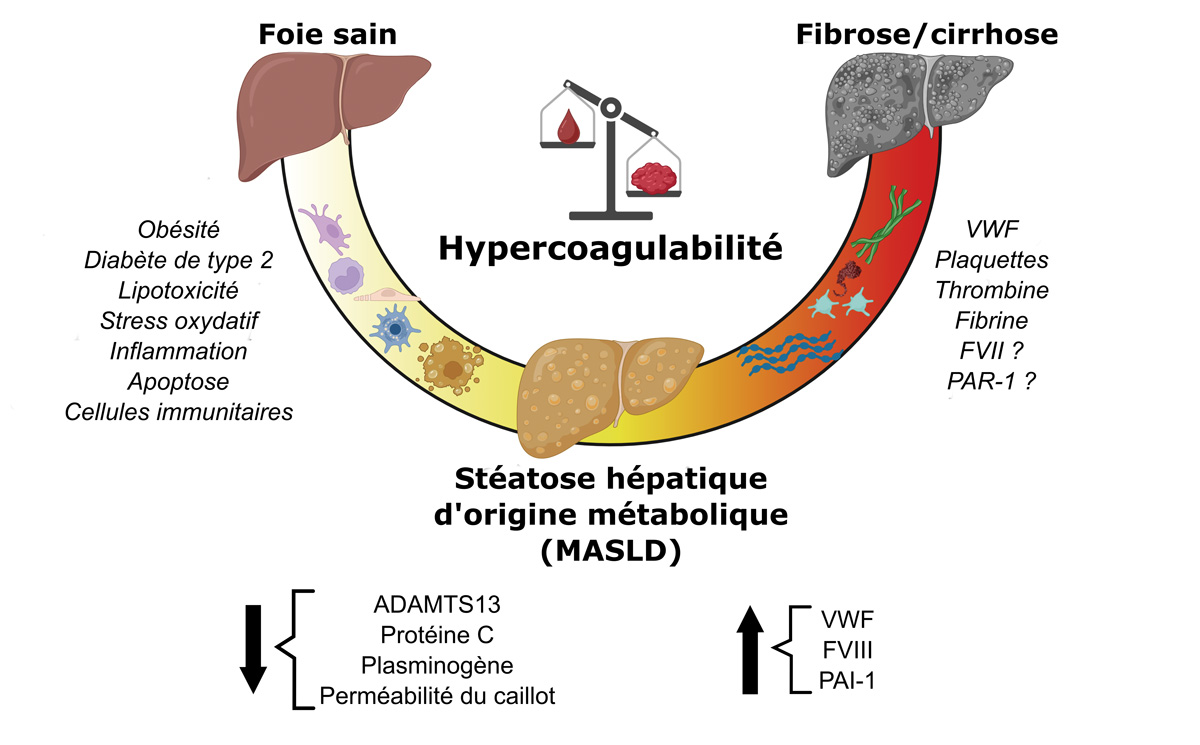
Aux stades les plus avancés, les pathologies hépatiques s’accompagnent également de perturbations de l’hémostase oscillant entre hypo- et hypercoagulabilité selon le stade de la maladie et les contextes cliniques. La MASLD semblerait particulièrement prédisposer à un risque thrombotique augmenté (3).
MASLD et hémostase primaire
Plusieurs altérations de l’hémostase primaire ont été mises en évidence dans la MASLD. Dans des modèles précliniques, une élévation des taux circulants de facteur von Willebrand (VWF), associée à une réduction de l’activité d’ADAMTS13 – la métalloprotéinase responsable du clivage du VWF – a été observée (4). Ce déséquilibre est également rapporté chez des patients présentant une défaillance hépatique chronique (5). Un déséquilibre entre VWF et ADAMTS13 pourrait favoriser l’agrégation plaquettaire et la formation de microthrombi au sein des sinusoïdes hépatiques, contribuant ainsi à l’inflammation chronique et à la progression de la fibrose hépatique.
Les plaquettes jouent également un rôle actif dans la progression de la maladie : elles participent au recrutement des cellules immunitaires circulantes (6), interagissent avec les cellules de Kupffer (7) et libèrent des médiateurs profibrosants, comme le TGF-β, activant les cellules stellaires hépatiques (8). Des études réalisées dans différents modèles animaux ont démontré que des médicaments antiplaquettaires tels que l’aspirine ou le clopidogrel pouvaient ralentir la progression de la MASH, notamment en réduisant l’inflammation et l’activation endothéliale (7). Néanmoins, d’autres études seront nécessaires pour évaluer l’implication des plaquettes dans les phases précoces du développement de la pathologie.
MASLD et coagulation
Les études cliniques rapportent des anomalies précoces de la coagulation associées à la MASLD, traduisant un état d’hypercoagulabilité progressif au fil de l’aggravation de la maladie vers la cirrhose hépatique (3). D’autre part, des travaux récents ont mis en évidence un rôle du facteur VII (FVII) dans la progression vers la MASH. La diminution de sa synthèse hépatique, observée dans les formes sévères, semble favoriser l’aggravation de la maladie. Des souris déficientes en FVII (KO FVII) développent une stéatohépatite exacerbée, liée à une absorption accrue des acides gras par les hépatocytes via la voie AKT/CD36. À l’inverse, la surexpression du FVII abolit cet effet et limite l’expression de gènes associés à l’inflammation et la fibrose, suggérant un rôle protecteur et un potentiel intérêt thérapeutique de ce facteur de la coagulation dans les formes inflammatoires de MASLD (9).
Le récepteur PAR-1 (gène F2r), principal effecteur cellulaire de la thrombine, est surexprimé dans les hépatocytes de souris sous régime riche en graisses. Son invalidation globale atténue la MASLD, contrairement à une délétion hépatocytaire, suggérant un rôle prédominant des interactions thrombine-cellules stellaires ou immunitaires. Le clivage canonique de PAR-1 par la thrombine favoriserait la NASH, tandis que son clivage non canonique par la protéine C activée pourrait exercer un effet protecteur. La parmoduline NRD-21, modulateur de PAR-1, réduit la stéatose et améliore le profil métabolique chez la souris obèse, ouvrant ainsi de nouvelles perspectives thérapeutiques (10).
MASLD et fibrinolyse
Le système fibrinolytique est également altéré dans la MASLD. Les patients présentent une baisse des taux circulants de plasminogène et une forte élévation des taux circulants de PAI-1 (inhibiteur de l’activateur du plasminogène de type 1), freinant l’activation de la fibrinolyse conduisant à des caillots plus denses et résistants à la lyse (11). Dans un modèle murin portant une mutation ciblée dans la chaîne γ de la fibrine (γ390-396), les souris sont protégées contre la stéatose induite par un régime hyperlipidique, la mutation empêchant les leucocytes de se fixer à la fibrine (12). Ce modèle souligne le rôle pro-inflammatoire et pro-fibrosant de la structure du caillot dans la progression de la MASLD.
CONCLUSION
La MASLD est donc associée à des perturbations de l’hémostase primaire, de la coagulation et de la fibrinolyse. Cette perturbation globale aboutit à un équilibre hémostatique fragile, penchant néanmoins vers un risque thrombotique. Ces observations suggèrent que les acteurs de l’hémostase ne sont pas de simples biomarqueurs, mais des contributeurs actifs de la progression et de la sévérité des lésions hépatiques (Figure 2). Ainsi, les anticoagulants ou les antiagrégants plaquettaires pourraient représenter à l’avenir une approche thérapeutique prometteuse dans la MASLD.