INTRODUCTION
Des procédures invasives sont fréquemment réalisées chez les patients atteints de cirrhose. Ces procédures constituent un véritable défi pour le praticien en raison de différents facteurs associés à la cirrhose. En effet, celle-ci est associée à un équilibre hémostatique fragile avec une perturbation des trois phases de l’hémostase. De plus, de nombreux patients atteints de cirrhose reçoivent des traitements antithrombotiques incluant les anticoagulants et les anti-agrégants plaquettaires, compliquant la gestion des procédures invasives. Enfin, il est démontré que la gravité de la cirrhose augmente le risque de saignement post-procédural (1). La survenue d’un saignement post-procédural est de surcroît associée à une morbi-mortalité importante chez ces patients (1,2). En conséquence, la prédiction et la prévention des saignements post-procéduraux sont essentielles pour améliorer la prise en charge des patients atteints de cirrhose devant subir une procédure invasive. Dans cette revue, nous discuterons d’abord des caractéristiques qui prédisent les saignements post-procéduraux dans la cirrhose, puis des stratégies préventives (incluant la gestion des antithrombotiques).
Prédiction du risque de saignement post-procédural
Trois éléments peuvent être pris en compte lors de l’évaluation du risque de saignement post-procédural des patients atteints de cirrhose : le risque inhérent à la procédure, les caractéristiques spécifiques du patient et les résultats du bilan biologique, bien que la valeur prédictive de ce dernier reste débattue.
Le risque de la procédure
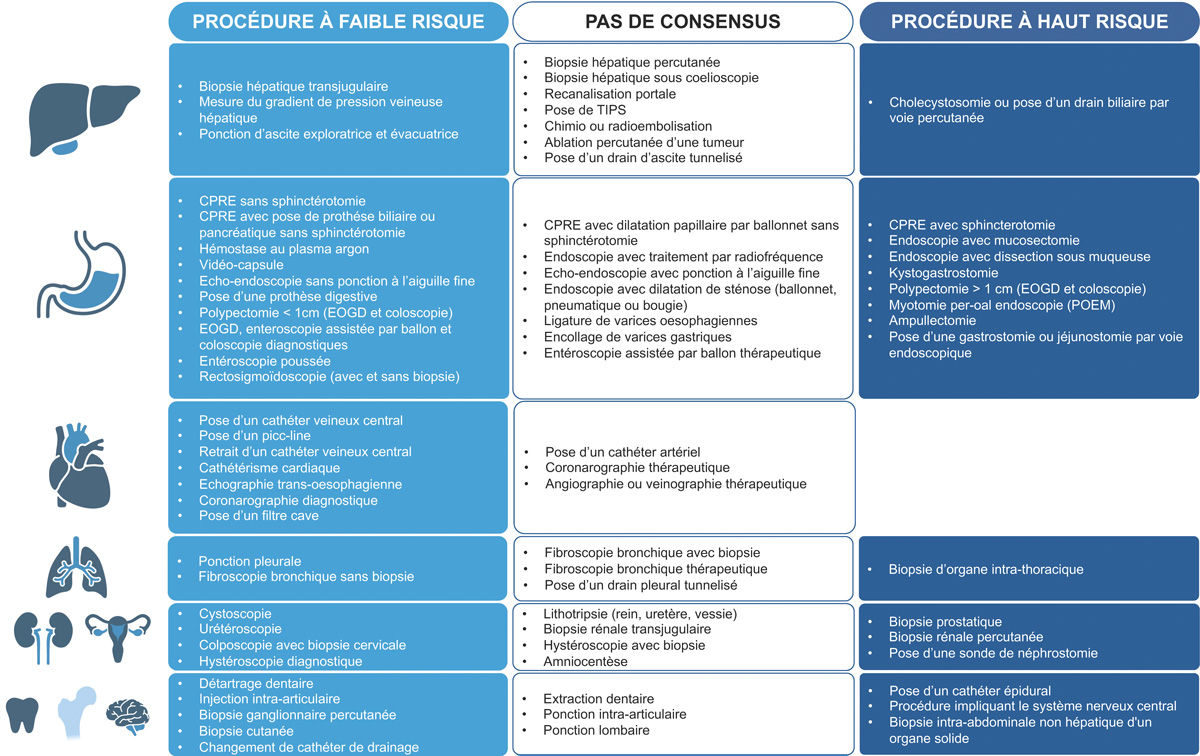
Le risque hémorragique lié à la procédure est essentiel à prendre en compte dans la gestion des procédures invasives chez les patients atteints de cirrhose car c’est l’un des facteurs prédictifs les plus importants de saignement post-procédural et il influence directement la gestion des traitements antithrombotiques dans la période péri-procédurale (1,3). Plusieurs classifications du risque associées aux procédures invasives chez les patients atteints de cirrhose ont été proposées ces dernières années par les sociétés savantes (4-9). Celles-ci présentent néanmoins plusieurs limites : (i) les procédures sont généralement classées à haut ou faible risque de saignement mais la définition d’une procédure à « haut risque » varie d’une recommandation à une autre, certaines la définissant comme un risque de saignement attendu (mineur ou majeur) supérieur à 1,5 % (5,8,9), tandis que d’autres utilisent ce même seuil mais uniquement pour le risque de saignement majeur (4,6) ; (ii) bien qu’utilisant la même définition, certaines recommandations n’ont pas abouti à la même classification du risque de la procédure. Par exemple, la biopsie hépatique transjugulaire a été classée comme présentant un haut risque de saignement dans certaines recommandations (4,8,9) et un risque faible dans d’autres (5,6).
Afin de proposer une prise en charge consensuelle, cinquante-deux experts de la coagulation dans les maladies du foie ont été invités à classer les procédures fréquemment pratiquées chez les patients atteints de cirrhose (10).Une procédure à haut risque a été définie comme toute rocédure associée à un risque estimé de saignement majeur supérieur à 1,5 %, ou de saignement mineur pouvant entraîner une morbidité significative ou la mort, comme un saignement intracrânien. Pour 52 des 80 procédures, plus de 75 % des experts étaient d’accord sur le risque de saignement associé à la procédure. Dix-sept procédures, principalement en endoscopie interventionnelle, des biopsies d’organes par voie percutanée et des procédures impliquant le système nerveux central, ont été classées comme présentant un haut risque de saignement, tandis que 35 procédures, principalement diagnostiques, ont été classées comme présentant un risque faible (Figure 1).
Bien que fondée sur l’opinion d’experts, cette étude représente une étape précieuse vers la standardisation des futures recherches, et aidera les cliniciens dans leur pratique quotidienne.
Abréviation : CPRE : cholangiopancréatographie rétrograde endoscopique.
Figure 1 : Risque de saignement associé aux procédures invasives chez les patients atteints de cirrhose selon un avis d’experts publié.
Figure 1: Risk of bleeding associated with invasive procedures in patients with cirrhosis according to published expert opinion.
Caractéristiques des patients
Insuffisance rénale
L’insuffisance rénale aiguë (IRA) chez les patients atteints de cirrhose est associée à des perturbations de l’hémostase résumées dans le tableau 1 (11-14). Certains changements sont associés à un risque accru de saignement et d’autres de thrombose. Cependant, les tests de coagulation globaux, tels que les tests de génération de thrombine (TGT), n’ont pas montré de modifications significatives de l’hémostase (11-14). Sur le plan clinique, une étude rétrospective portant sur 83 patients atteints de cirrhose décompensée a montré que l’IRA était le seul facteur prédictif indépendant d’hémopéritoine après une ponction d’ascite (15). Cependant, deux autres études, incluant des patients à tous les stades de gravité de la cirrhose, n’ont pas confirmé cette association (1,3).
Infection bactérienne
Les perturbations de l’hémostase observées au cours des infections bactériennes chez les patients atteints de cirrhose sont résumées dans le tableau 1 (14,16-18). Deux tests d’hémostase globaux – la thromboélastographie (TEG) et le TGT sur sang total – ont identifié un profil d’hypocoagulabilité chez les patients atteints de cirrhose au cours d’une infection bactérienne (14,18). Une étude a rapporté un risque plus élevé de saignement après la ligature de varices œsophagiennes chez les patients infectés (19), mais d’autres études n’ont pas trouvé d’association significative entre l’infection bactérienne et l’augmentation du risque de saignement post-procédural (1,3,15).
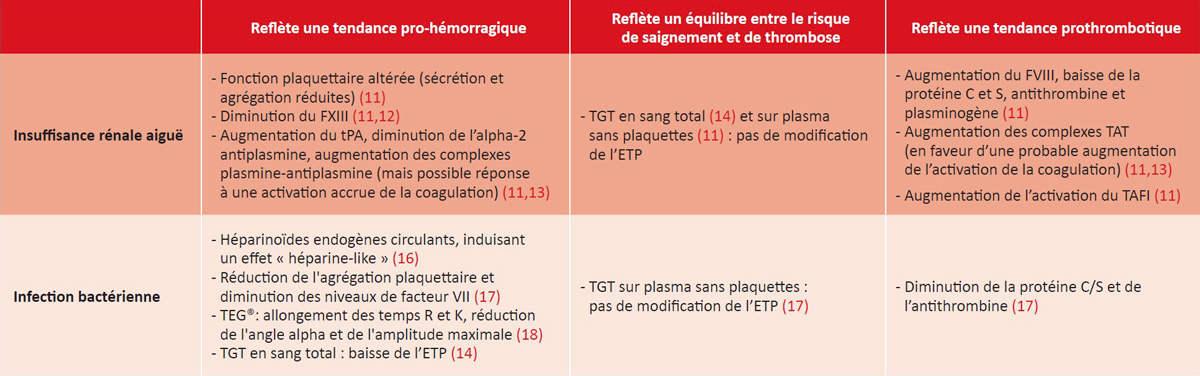
Abréviations : ETP : endogenous thrombin potential, potentiel de thrombine endogène ; TAFI : thrombin-activated fibrinolytic inhibitor, inhibiteur fibrinolytique activé par la thrombine ; TAT : thrombin-antithrombin, thrombine-antithrombine ; TEG : thromboélastographie ; TGT: test de génération de thrombine ; tPA : tissue plasminogen activator, activateur tissulaire du plasminogène
Anémie
Les globules rouges contribuent à l’hémostase en favorisant l’interaction des plaquettes avec la paroi du vaisseau et donc l’adhésion, mais aussi l’agrégation des plaquettes : au niveau des sites, elles sont stratégiquement placées pour réagir face aux lésions vasculaires (20). Une étude a montré qu’un taux d’hémoglobine plus faible était associé aux saignements post-ligature de varices œsophagiennes et post-polypectomie au cours d’une coloscopie (19), mais d’autres études n’ont pas trouvé de telles associations (1,21).
Bien que les données de la littérature soient limitées et parfois discordantes, les recommandations actuelles conseillent de corriger et/ou traiter une insuffisance rénale aiguë, une infection bactérienne ou une anémie avant une procédure invasive chez les patients atteints de cirrhose (4,6,7,10).
Gravité de la cirrhose
La gravité de la cirrhose – indiquée par un MELD (1,19) ou un score de Child-Pugh (22-26) plus élevé – a été clairement identifiée comme un facteur de risque indépendant de saignements post-procéduraux. De plus, les saignements post-procéduraux survenant chez des patients atteints de cirrhose décompensée, qui sont déjà dans un état fragile, sont plus susceptibles d’entraîner une morbi-mortalité significative par rapport aux patients atteints de cirrhose compensée (27).
Anti-agrégants plaquettaires
Les agents antiplaquettaires, communément dénommés anti-agrégants plaquettaires (AAP), comprennent les inhibiteurs de la cyclooxygénase 1 (aspirine), et les inhibiteurs des récepteurs P2Y12 (clopidogrel, prasugrel, ticagrelor). Leur effet sur le risque de saignement post-procédural n’est pas bien documenté chez les patients atteints de cirrhose. Une étude a montré que l’utilisation d’AAP était associée à une incidence plus élevée de saignements, mais il s’agissait principalement de saignements spontanés et de saignements liés à l’hypertension portale, et pas spécifiquement de saignements post-procéduraux (28). La vaste étude prospective PROC-BLeeD a identifié que le clopidogrel était associé à une incidence plus élevée de saignements post-procéduraux en analyse univariée, mais le faible nombre de patients concernés n’a pas permis d’effectuer une analyse multivariée (1). D’autres études n’ont pas trouvé d’association significative entre l’utilisation d’AAP et les saignements post-procéduraux, mais l’utilisation peu fréquente de ces médicaments dans les études empêche toute conclusion définitive (1,19,29). Des essais spécifiques testant l’interruption ou non de l’aspirine chez les patients atteints de cirrhose seraient nécessaires pour guider la pratique clinique, mais seront difficiles à réaliser étant donné la faible incidence des saignements.
Anticoagulants
Les anticoagulants incluent l’héparine (non fractionnée et de bas poids moléculaire), les antagonistes de la vitamine K (AVK) et les anticoagulants oraux directs (AOD). Chez les patients atteints de cirrhose, l’importante littérature sur la sécurité des AVK et des AOD s’est concentrée sur les saignements spontanés (gastro-intestinaux et intracrâniens) ou liés à l’hypertension portale plutôt que les saignements post-procéduraux (30-33). Une étude n’a pas identifié de risque accru de saignement sous HBPM après ligature de varices œsophagiennes (34). Cependant, des études observationnelles ont rapporté une incidence significative de saignements suivant les procédures invasives chez les patients atteints de maladie hépatique chronique traités par anticoagulants (1,19,35,36). Par conséquent, une gestion prudente des anticoagulants est nécessaire lors de la planification d’une procédure invasive chez les patients atteints de cirrhose.
Index de masse corporel élevé
Un index de masse corporel élevé a récemment été identifié comme un facteur de risque de saignement post-procédural chez les patients atteints de cirrhose (1). Ceci peut être lié à des difficultés techniques pendant les procédures, car l’excès de tissu adipeux peut masquer les repères anatomiques et potentiellement compliquer la procédure.
Tests d’hémostase
Taux de prothrombine (TP) et International Normalized Ratio (INR)
Le TP et l’INR sont largement utilisés dans la prise en charge des patients atteints de cirrhose pour calculer les scores de sévérité de la cirrhose (Child-Pugh, MELD). Cependant, il est clairement démontré dans la littérature que ce ne sont pas des prédicteurs fiables des saignements post-procéduraux (1,37).
Plaquettes
La thrombopénie est fréquente au cours de la cirrhose, affectant jusqu’à 78 % des patients (38). L’utilité du compte plaquettaire pour prédire les saignements post-procéduraux est très discutée dans la littérature. Les données concordent cependant pour affirmer qu’au-delà de 75.10⁹/L, le risque de saignement post-procédural n’est pas augmenté, ce qui concerne finalement la grande majorité des patients atteints de cirrhose (1,2,39-41). En dessous de 75,10⁹/L plaquettes, le seuil exact à partir duquel le risque de saignement post-procédural est augmenté n’a pas été encore déterminé notamment en raison des limites de ces études. En effet, (i) les patients présentant une thrombopénie très profonde (par exemple < 30.10⁹/L) n’étaient souvent pas inclus et/ou avaient souvent reçu une transfusion de plaquettes avant la procédure ; (ii) les épisodes de saignements majeurs n’étaient pas distingués des mineurs. Par conséquent, aucune conclusion définitive ne peut être tirée de la littérature disponible sur la valeur prédictive de la numération plaquettaire pour le risque de saignement post-procédural. D’autres études prospectives randomisées sont nécessaires pour évaluer, chez les patients atteints de thrombopénie sévère, le risque hémorragique lié à la procédure et la meilleure prise en charge dans ce contexte.
Tests viscoélastiques
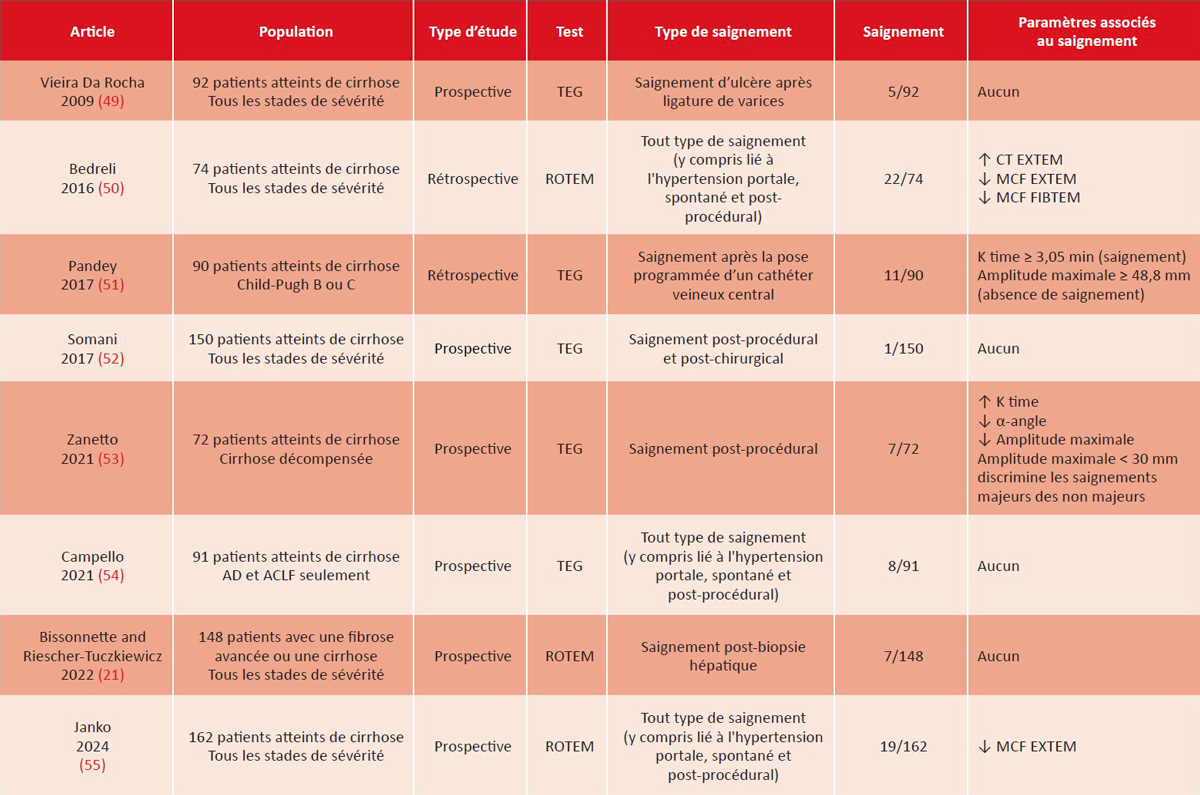
Les tests viscoélastiques, tels que la thromboélastométrie rotationnelle (ROTEM) et la thromboélastographie (TEG), offrent une évaluation plus complète de l’hémostase chez les patients atteints de cirrhose car (i) ils incluent la dynamique de la formation, de la stabilisation et de la lyse des caillots, et (ii) ils sont réalisés sur du sang total, prenant en compte le rôle des cellules et des protéines plasmatiques. Plusieurs essais contrôlés randomisés ont démontré la valeur de ces tests pour réduire le besoin de transfusion de produits sanguins chez les patients atteints de cirrhose qui ont une procédure invasive ou une transplantation (42-48). Cependant, leur valeur prédictive pour les saignements post-procéduraux reste incertaine, avec des données discordantes entre les différentes études, comme le résume le tableau 2 (21,49-55). Cette discordance peut être attribuée à l’hétérogénéité des études en termes de types de procédures réalisées (allant de procédures à faible risque de saignement à des procédures à haut risque), des types de saignement (post-procédural vs lié à l’hypertension portale), et de patients inclus ayant différents degrés de gravité de cirrhose. Par conséquent, il n’y a pas suffisamment de preuves pour soutenir l’utilisation systématique des tests viscoélastiques dans la prédiction des saignements post-procéduraux dans la cirrhose et ils ne sont donc pas recommandés à l’heure actuelle (4-6). En outre, la disponibilité limitée des tests
viscoélastiques est un obstacle à leur utilisation.
Test de génération de thrombine
Le TGT est un test de coagulation global qui permet de prendre en compte l’activité des anticoagulants naturels du plasma (comme la protéine C) en ajoutant de la thrombomoduline soluble, une protéine présente sur l’endothélium, et qui permet l’activation de la protéine C par la thrombine. Il peut être réalisé sur du plasma sans plaquette ou sur sang total. Trois études prospectives ont montré que le TGT réalisé sur du plasma sans plaquette ne prédit pas les saignements post-procéduraux (21,56,57). A l’inverse, Zanetto et al. ont observé, chez des patients atteints de cirrhose décompensée, que l’altération des paramètres de TGT sur sang total permettait de prédire les saignements post-procéduraux majeurs (56). Ces résultats doivent toutefois être confirmés par d’autres études indépendantes.Dans l’ensemble, le bilan biologique semble avoir une valeur limitée dans la prédiction des saignements post-procéduraux, bien qu’il soit impossible de tirer des conclusions définitives pour la numération plaquettaire.
Tableau 2 : Études évaluant la capacité des tests viscoélastiques à prédire les saignements post-procéduraux chez les patients atteints de cirrhose.
Table 2: Studies evaluating the ability of viscoelastic tests to predict post-procedural bleeding in patients with cirrhosis.
Abréviations : ACLF : acute on chronic liver failure, insuffisance hépatique aiguë sur chronique ; CT : clotting time, temps de coagulation ; MCF : maximum clot firmness, fermeté maximale du caillot ; ROTEM : thromboélastométrie rotative ; TEG : thromboélastographie.
Néanmoins, la numération plaquettaire, le taux d’hémoglobine et l’INR peuvent être utiles, en particulier avant les interventions à haut risque, car ils donnent une vue d’ensemble de l’état hémostatique de base et peuvent guider la prise en charge en cas de complications hémorragiques. En outre, la numération plaquettaire et l’INR peuvent alerter les cliniciens sur des coagulopathies non liées à la cirrhose ou signaler la nécessité d’une plus grande prudence ou d’un report de l’intervention si l’INR révèle une aggravation de la fonction hépatique. Alors que le TGT sur du plasma sans plaquette ne prédit pas les saignements post-procéduraux, d’autres études sont nécessaires pour évaluer les tests viscoélastiques et le TGT sur sang total.
Prévention des saignements
Gestion péri-procédurale des antithrombotiques
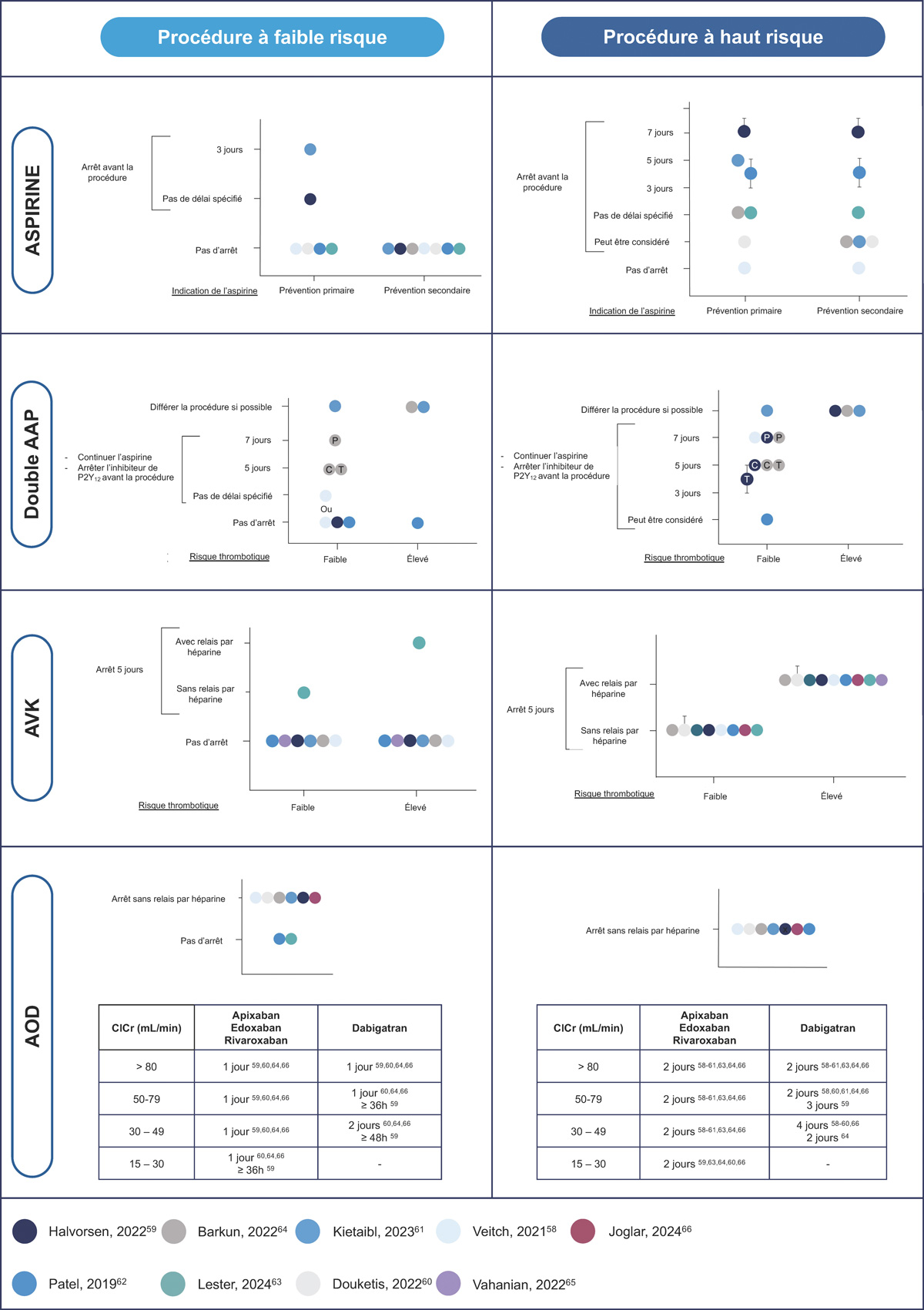
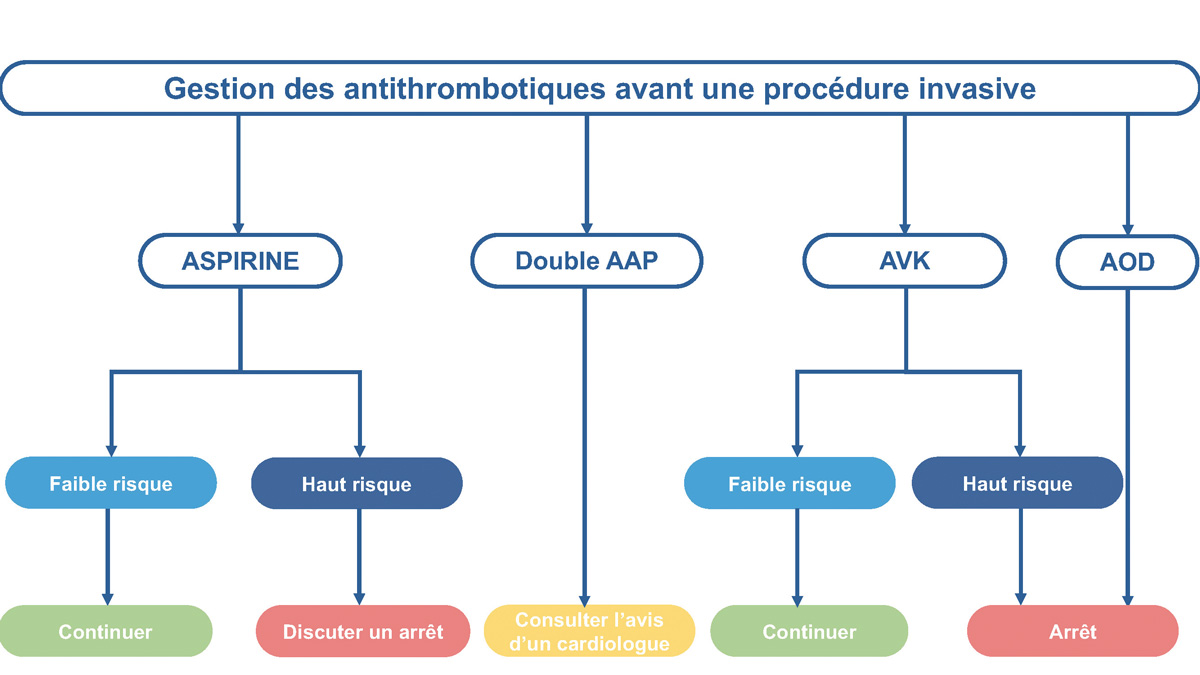
La gestion des médicaments antithrombotiques pendant la période péri-procédurale nécessite de prendre en compte l’indication du traitement (prévention primaire ou secondaire), le risque thrombotique du patient, l’indication de l’intervention, son risque hémorragique et son degré d’urgence. Au cours des cinq dernières années (2019-2024), plusieurs sociétés savantess, i.e. cardiologie, hépatologie, gastro-entérologie, pneumologie, anesthésie, thrombose et hémostase, hématologie et radiologie interventionnelle, ont émis des recommandations sur la gestion des traitements antithrombotiques dans le cadre de procédures ou chirurgies programmées dans la population générale (58-70). Ces recommandations sont résumées dans le paragraphe ci-dessous et dans la figure 2. Celles-ci sont également appliquées aux patients atteints de cirrhose en l’absence d’étude dédiée à la gestion des antithrombotiques en contexte péri-procédural dans la cirrhose.
Abréviations : CrC : clairance de la créatinine ; C : clopidogrel ; P : prasugrel ; T : ticagrelor.
Figure 2 : Résumé des recommandations actuelles sur l’interruption des antiplaquettaires et des anticoagulants avant une procédure invasiveou une intervention chirurgicale.
Figure 2: Summary of current recommendations on discontinuing antiplatelet and anticoagulant therapy prior to invasive procedures or surgery.
Les AVK mentionnés dans la figure font référence à la warfarine. Les délais sont différents pour l’acénocoumarol (3 jours) et le phenprocoumone (7 à 12 jours).
Dans la population générale
Agents antiplaquettaires
L’aspirine est largement utilisée dans la population générale, soit pour la prévention primaire chez les personnes présentant un risque élevé de maladie cardiovasculaire athéromateuse, soit pour la prévention secondaire chez les personnes souffrant déjà d’une maladie cardiovasculaire (71). Pour les interventions à faible risque de saignement, la plupart des recommandations préconisent la poursuite de l’aspirine. Pour les interventions présentant un haut risque, il existe un consensus en faveur de l’interruption de l’aspirine, sauf pour la plupart des interventions endoscopiques (à l’exception de l’ampullectomie), pour lesquelles l’aspirine peut être poursuivie (58-64). La durée de l’interruption avant l’intervention varie de 3 à au moins 7 jours (59,61,62). Le moment approprié pour reprendre l’aspirine après l’intervention varie de « dès que possible » à « dans les 48 heures » (59,61,62).
Les inhibiteurs de P2Y12 sont principalement prescrits dans le cadre d’une double anti-agrégation plaquettaire (DAAP) en association avec l’aspirine (après un syndrome coronarien aigu ou une intervention coronarienne percutanée), mais également en monothérapie dans le cadre d’une désescalade après la DAAP, ou en raison d’un accident vasculaire cérébral récent, d’une maladie artérielle périphérique ou d’une intolérance à l’aspirine (59). Chez les patients présentant un risque thrombotique élevé, l’interruption de la DAAP augmente significativement le risque d’événements ischémiques (59). Il est donc préférable de maintenir la DAAP en cas d’intervention à faible risque hémorragique ou de reporter l’intervention programmée jusqu’à ce que la DAAP soit complètement terminée (59-62). Chez les patients présentant un faible risque thrombotique, la DAAP peut être poursuivie (uniquement en cas d’intervention à faible risque hémorragique) ou les inhibiteurs de P2Y12 peuvent être interrompus tout en continuant l’aspirine (58,59,62,64).Les inhibiteurs de P2Y12 sont interrompus 3 à 5 jours pour le ticagrelor, 5 jours pour le clopidogrel et 7 jours pour le prasugrel, avant l’intervention (59,61,64). Il est généralement indiqué de reprendre les médicaments antiplaquettaires dans les 24-48 heures (58,59,61).
Anticoagulants
La plupart des recommandations s’accordent sur la gestion des AVK dans la période péri-procédurale/chirurgicale. En cas d’intervention à faible risque hémorragique, la poursuite de l’AVK est indiquée (58,59,61,62,64,65). L’INR doit être vérifié avant l’intervention chirurgicale pour s’assurer qu’il ne dépasse pas la fourchette thérapeutique ou qu’il se situe dans la fourchette inférieure si les AVK sont poursuivis (58,59). En cas d’intervention à haut risque hémorragique, la suspension des AVK est la règle (58-62,64,65). La warfarine est interrompue 5 jours, le phenprocoumone 7 à 12 jours et l’acénocoumarol 3 jours, avant l’intervention. En cas de risque de thrombose faible (fibrillation auriculaire avec un score CHADS2VASC2 non élevé, thrombose veineuse > 3 mois, valve cardiaque mécanique sans autre facteur de risque de thrombose), un relais par héparine n’est pas indiqué (72,73). Le relais peut néanmoins être bénéfique pour un sous-groupe de patients présentant un risque très élevé de thrombose. Dans ces cas sélectionnés, l’avis d’un cardiologue doit être demandé pour déterminer la meilleure gestion de l’anticoagulation péri-procédurale. Les AVK peuvent généralement être repris rapidement après l’intervention chirurgicale ; le moment suggéré dans les différentes recommandations est, soit « le soir de l’intervention », soit « dans les 24 heures après l’intervention » (58-61,63,65,66).
La gestion des anticoagulants oraux directs (AOD) est consensuelle dans les recommandations. L’arrêt des AOD est recommandé avant d’effectuer une intervention chirurgicale ou une procédure quel que soit le risque hémorragique, sans relais par héparine (58-61,64,66). Le nombre de jours d’arrêt et de reprise des AOD dépend du risque hémorragique de l’intervention, du type d’AOD et de la fonction rénale du patient. Le report d’une intervention chirurgicale non urgente doit être envisagé chez les patients dans les 3 mois suivant une thrombose veineuse profonde, un accident vasculaire cérébral ou un accident ischémique transitoire (64).
Chez les patients atteints de cirrhose
Certaines spécificités liées à la maladie hépatique doivent être prises en compte lors de la planification des procédures invasives chez les patients atteints de cirrhose traités par antithrombotiques. Tout d’abord, la pharmacocinétique des médicaments antithrombotiques peut être modifiée en raison (i) d’une hypoalbuminémie entraînant une concentration circulante plus élevée de médicaments non liés à l’albumine avec un impact sur leur clairance et leur toxicité (74,75), (ii) d’une clairance hépatique retardée entraînant des concentrations plasmatiques plus élevées de certains médicaments (apixaban, rivaroxaban) (76), (iii) d’une clairance rénale fréquemment altérée, ce qui compromet encore davantage l’excrétion des médicaments (77). De plus, la pharmacodynamique des anticoagulants chez les patients atteints de cirrhose est également altérée avec une augmentation ou diminution de l’effet anticoagulant observé dans des études in vitro utilisant le TGT (78-83). Enfin, la surveillance des AVK avant une procédure invasive est difficile chez les patients atteints de cirrhose sévère, car l’INR varie selon la gravité de la maladie hépatique et l’effet des AVK (84). Cependant, aucune étude n’a pour l’heure spécifiquement examiné le moment optimal pour arrêter le traitement antithrombotique chez les patients atteints de cirrhose. Par conséquent, les recommandations conçues pour la population générale sont actuellement utilisées également chez les patients atteints de cirrhose. Dans l’attente d’études spécifiques aux patients atteints de cirrhose, nous proposons un algorithme pour la gestion du traitement antithrombotique (Figure 3), ainsi que des suggestions pour le moment de l’arrêt et de la reprise des anticoagulants (Figure 4), sur la base des recommandations mentionnées ci-dessus pour les patients ne souffrant pas de maladie du foie. Le moment de la reprise du traitement antithrombotique doit toujours prendre en compte l’avis du médecin qui a pratiqué l’intervention, en particulier en ce qui concerne son évaluation de l’hémostase à la fin de l’intervention.
Adaptée de Riescher-Tuczkiewicz et al., Clinical and Molecular Hepatology 2025 (119)
Abréviations : AOD : anticoagulant oral direct ; AVK : antagoniste de la vitamine K.
Figure 3 : Gestion suggérée des médicaments antithrombotiques dans la période péri-procédurale chez les patients atteints de cirrhose, dérivée de celle proposée dans la population générale.
Figure 3: Suggested management of antithrombotic drugs in the peri-procedural period in patients with cirrhosis, derived from that proposed in the general population.
Pour les interventions à faible risque hémorragique, l’aspirine doit généralement être maintenue. Pour les procédures à haut risque hémorragique, la plupart des procédures endoscopiques (à l’exception de l’ampullectomie) peuvent encore être réalisées en toute sécurité avec de l’aspirine. Pour d’autres interventions à haut risque, l’arrêt de l’aspirine peut être envisagé, mais la décision doit mettre en balance le risque de saignement et le risque de thrombose, l’avis d’un cardiologue étant particulièrement précieux dans ces cas. Les décisions concernant le DAAP sont plus complexes, car ces médicaments sont souvent prescrits à la suite d’une angioplastie coronarienne ou un syndrome coronarien aigu. Dans ces cas, l’avis du cardiologue est essentiel pour guider la prise en charge. Le traitement par AVK peut généralement être poursuivi pour les interventions à faible risque hémorragique. Cependant, pour les interventions à risque hémorragique élevé, il est recommandé de l’interrompre. Chez les patients présentant un risque thrombotique très élevé, un relais par héparine peut être envisagé. Pour les interventions à risque hémorragique faible ou élevé, il est généralement conseillé d’interrompre le traitement par AOD sans relais
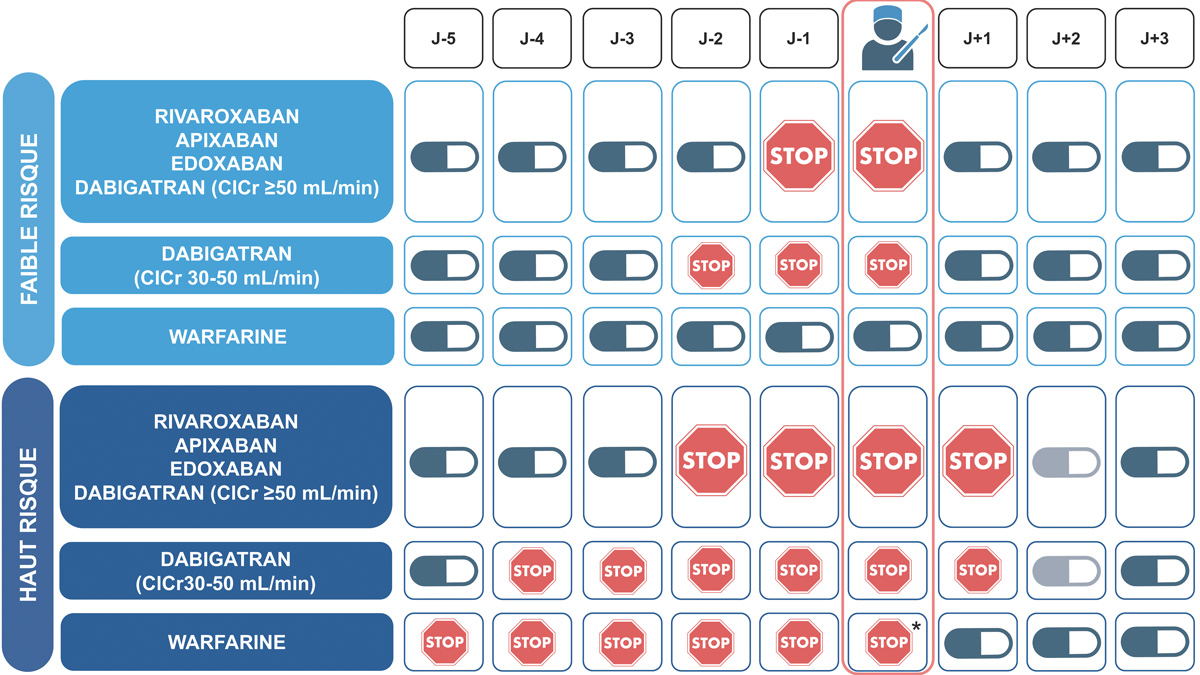
Adaptée de Rieschert-Tuczkiewicz et al., Clinical and Molecular Hepatology 2025 (119)
* Les AVK peuvent être repris le soir de l’intervention.
Abréviations : AOD : anticoagulant oral direct ; AVK : antagoniste de la vitamine K.
Figure 4 : Moment suggéré pour l’interruption et la reprise des anticoagulants dans la période péri-procédurale chez les patients atteints de cirrhose.
Figure 4: Suggested timing for interruption and resumption of anticoagulants in the peri-procedural period in patients with cirrhosis.
En ce qui concerne l’arrêt des médicaments antithrombotiques, le nombre de jours mentionné se réfère au nombre de jours entiers avant le jour de la procédure/chirurgie pendant lesquels le patient ne prend aucune dose de médicaments antithrombotiques. Les médicaments ne sont pas non plus pris le jour de l’intervention chirurgicale.
Les AVK mentionnés dans la figure se réfèrent à la warfarine. Le calendrier est différent pour l’acénocoumarol (3 jours) et le phenprocoumone (7 à 12 jours). En fonction de l’intervention et de l’hémostase, l’AOD peut être repris le soir du deuxième jour ou troisième jour après une
intervention à haut risque hémorragique.
Autres mesures préventives avant une procédure invasive chez les patients atteints de cirrhose
Aspects techniques
Le guidage échographique de procédures telles que la biopsie percutanée du foie, la dérivation portosystémique intrahépatique transjugulaire (TIPS), la ponction d’ascite et la pose de cathéters veineux centraux a été associé à une incidence plus faible de complications, y compris de saignements post-procédure, par rapport à l’absence d’échographie, bien que la population incluse dans les études ne comprenait pas toujours des patients atteints de cirrhose (85-92).
L’impact de l’expérience de l’opérateur sur les saignements post-procéduraux n’est pas clair. Alors que certaines études suggèrent que les opérateurs expérimentés ou les centres prenant en charge un grand nombre de patients ont moins de saignements post-procéduraux (23,93), d’autres ne montrent aucun effet (27,94), et certaines indiquent même un risque accru de saignement avec des opérateurs plus expérimentés (93), à la fois chez les patients avec et sans cirrhose. Il est probable qu’un biais de sélection soit à l’origine de ces résultats, les patients présentant un risque de saignement plus élevé ou ceux pour lesquels la procédure semble plus compliquée étant orientés vers un opérateur expérimenté ou un centre expert.Enfin, la voie par laquelle la procédure invasive est réalisée est également importante. Par exemple, la voie transjugulaire pour la biopsie rénale ou hépatique semble être une option plus sûre chez les patients souffrant d’une maladie hépatique chronique pour lesquels la voie percutanée n’est pas réalisable en raison d’une hémostase altérée (95-98).
Mesures pour corriger l’hémostase
La transfusion de plaquettes est classiquement utilisée avant les procédures invasives pour augmenter le nombre de plaquettes chez les patients souffrant d’une maladie hépatique chronique et d’une thrombopénie sévère. Des études in vitro montrent que l’administration d’une dose standard de plaquettes n’entraîne qu’une faible augmentation de leur nombre (numération plaquettaire = 39.109/L (16-64) vs 52.109/L (19-91)) sans normaliser la génération de thrombine et les tests viscoélastiques (99). De plus, l’augmentation du compte plaquettaire après la transfusion est transitoire et variable d’un patient à l’autre et celle-ci induit des risques de réactions transfusionnelles potentiellement néfastes (100). Enfin, aucune étude n’a démontré son efficacité dans la réduction des saignements post-procédure. L’avatrombopag et le lusutrombopag, qui sont des agonistes du récepteur de la thrombopoïétine (TPO-RA), stimulent la production de plaquettes dans la moelle osseuse. Par rapport au placebo, ces médicaments réduisent le besoin de transfusions plaquettaires en péri-procédural et permettent d’atteindre un compte plaquettaire > 50.109/L avant l’intervention, sans différence significative en termes de complications thrombotiques (101-106). En outre, leur effet dure jusqu’à deux semaines, ce qui peut être souhaitable chez les patients présentant des saignements post-procéduraux tardifs. Cependant, aucun essai contrôlé randomisé n’a évalué leur efficacité dans la réduction des saignements post-procéduraux et un délai d’action de 8 à 13 jours est nécessaire, limitant leur utilisation au contexte des procédures programmées.
Les recommandations actuelles ne recommandent pas de corriger la thrombopénie chez les patients atteints de cirrhose en cas de compte plaquettaire ≥ 50.109/L (4-6,8,107). Lorsque le compte plaquettaire est < 50.109/L, les recommandations varient d’une société à une autre, certaines suggérant de ne pas le corriger systématiquement, tandis que d’autres suggèrent une correction dans des cas très spécifiques associés à un risque élevé de saignement (procédure à très haut risque, hémostase locale impossible, numération plaquettaire < 20.109 /L) (4-6,8).
Les patients atteints de cirrhose peuvent présenter une hypofibrinogénémie et/ou une dysfibrinogénémie, c’est-à-dire un fibrinogène fonctionnellement anormal (108-110). Deux études ont suggéré que l’ajout de concentré de fibrinogène in vitro dans le plasma de patients atteints de cirrhose améliorait les propriétés structurelles du caillot de fibrine et diminuait la perméabilité du caillot (82,111). Cependant, la concentration plasmatique de fibrinogène n’est pas un facteur prédictif clair de saignement post-procédural et aucune étude prospective n’a évalué l’intérêt de la perfusion de fibrinogène chez les patients atteints de cirrhose avant des procédures invasives (1,21). Par conséquent, la correction systématique du fibrinogène avant les procédures invasives chez les patients atteints de cirrhose n’est pas recommandée (4,5,8).
Le plasma frais congelé (PFC) contient à la fois des facteurs de coagulation et des protéines anticoagulantes. Son utilisation pour corriger l’INR avant les procédures invasives chez les patients atteints de cirrhose n’est cependant pas recommandée pour plusieurs raisons : (i) l’effet biologique du PFC reste incertain, certaines études suggérant un effet prothrombotique alors que d’autres n’ont montré aucun effet ou même une légère réduction de la génération de thrombine (112-114), (ii) il n’existe aucune preuve que le PFC réduit le risque de saignement post-procédural chez les patients atteints de cirrhose ; (iii) son utilisation est associée à des effets secondaires significatifs (115-118).
Dans l’ensemble, la correction des anomalies de la coagulation avant les procédures invasives devrait être limitée à la thrombopénie sévère, avec des seuils jusqu’à présent peu clairs (entre 20 et 50.109/L).
CONCLUSION
La prise en charge des procédures invasives chez les patients atteints de cirrhose nécessite d’abord une évaluation du risque hémorragique associé à la procédure, en tenant compte des caractéristiques du patient, de la procédure et du bilan biologique. La prévention des saignements post-procéduraux inclut la gestion des traitements antithrombotiques et la correction des facteurs potentiels de risque, notamment l’IRA et les infections bactériennes, bien que le bénéfice lié à la correction de ces dernières n’ait pas été formellement démontré. L’intérêt des médicaments et des produits dérivés du sang pour prévenir les saignements post-procéduraux n’a pas été démontré dans ce contexte.
POINTS CLÉS À RETENIR
• Les principaux facteurs prédictifs de saignement post-procédural chez les patients atteints de cirrhose sont les procédures à haut risque hémorragique, la sévérité de la cirrhose et un IMC plus élevé.
• Le bilan d’hémostase standard ne semble pas avoir d’intérêt pour prédire ces saignements mais la place du compte plaquettaire, des tests viscoélastiques et du test de génération de thrombine sur sang total reste à définir.
• L’intérêt de corriger les anomalies de l’hémostase avant un geste invasif pour réduire le risque de saignement n’a pas été démontré.