RÉSUMÉ
La Revue Francophone d’Hémostase et Thrombose vous propose, outre la réception trimestrielle de la revue, des publications online régulières sur la plateforme www.rfht.fr sous la forme :En partenariat avec 
La Revue Francophone d’Hémostase et Thrombose vous propose, outre la réception trimestrielle de la revue, des publications online régulières sur la plateforme www.rfht.fr sous la forme :
• d’une veille bibliographique avec les meilleurs articles publiés dans nos spécialités ;
• d’actualités commentées offrant une vision critique d’une sélection d’articles internationaux et leur mise en perspective en pratique clinique.
Vous trouverez ci-après une sélection de ces articles récents, décryptés, analysés et commentés pour vous par Antoine Babuty, Alexandre Guy et Laure Macraigne.
FIDANACOGENE ELAPARVOVEC POUR L’HÉMOPHILIE B – UNE ÉTUDE DE SUIVI SUR PLUSIEURS ANNÉES
D’après : Fidanacogene Elaparvovec for Hemophilia B – A Multiyear Follow-up Study. Rasko JEJ, Samelson-Jones BJ, George LA, Giermasz A, Ducore JM, Teitel JM, et al. N Engl J Med 2025 ; 392 : 1508-17.
Actualité commentée réalisée par Antoine BABUTY
Justificatifs et objectifs
L’hémophilie B est une maladie génétique caractérisée par un déficit en facteur IX (FIX), entraînant des saignements spontanés et des complications articulaires. Le traitement repose sur l’administration de facteurs de coagulation, associée à des enjeux d’efficacité et d’observance. La thérapie génique à l’aide de vecteurs adéno-associés (AAV) offre une alternative thérapeutique permettant une correction durable du déficit en FIX. Cette étude visait à évaluer la sécurité et l’efficacité à long terme du fidanacogene elaparvovec, un vecteur AAV codant pour une version hyperactive du facteur IX (FIX-Padua- FIX-R338L), chez des patients atteints d’hémophilie B (HB) modérée et sévère (FIX ≤ 2 %).
Méthodes
Cette étude de phase I-IIa incluait des patients HB modérés et sévères (FIX ≤ 2 %). Ils recevaient une injection unique de 5 × 1011 copies de génome par kilogramme. Un suivi de 6 ans était réalisé pour évaluer la sécurité et l’efficacité du traitement. La sécurité du traitement comprenait l’évaluation de la fonction hépatique, notamment par échographie, la survenue d’effets indésirables, le développement d’anticorps anti-FIX et anti-capside de l’AAV. L’efficacité du traitement était évaluée par le nombre de saignements annualisé nécessitant un traitement par FIX, la consommation en FIX, le taux de FIX plasmatique et le nombre de patients ne rapportant aucun saignement.
Résultats
Quinze patients ont été inclus, avec un suivi médian de 5,5 ans [3-6 ans]. Aucun effet indésirable lié au traitement n’était rapporté après la première année. Aucun patient n’a présenté de thrombose ni développé d’anticorps anti-FIX. Trois patients ont reçu des corticoïdes la première année en raison d’une élévation des enzymes hépatiques. Quatre patients ont présenté une stéatose hépatique associée à un BMI supérieur à 25, sans signes de cancer ou de défaillance hépatique grave ; 3 n’avaient pas eu d’évaluation antérieure et le quatrième avait une stéatose hépatique pré-thérapeutique. Un autre participant, ayant des antécédents de fibrose hépatique avancée, a présenté une progression de sa fibrose sous-jacente, probablement liée à ses comorbidités. Le taux de FIX 4 ans après injection était supérieur à 5 % (14/15 patients évaluables). Le taux de saignement annuel moyen était inférieur à 1 tout au long du suivi. Le taux de saignement annuel médian était de 0. Dix patients n’ont présenté aucun saignement. Le nombre moyen d’injections de FIX par an avant thérapie génique était de 71,2 versus 1,1 après thérapie génique.
Avis d’expert
Les résultats de cette étude mettent en évidence l’efficacité durable ainsi que la sécurité d’utilisation de la thérapie génique par fidanacogene elaparvovec chez des adultes atteints d’hémophilie B sévère sur une période allant jusqu’à six ans. Les patients obtenaient des taux de FIX correspondant au minimum à une hémophilie mineure tout en réduisant considérablement la survenue d’épisodes hémorragiques et la consommation de facteurs de coagulation.
Les effets indésirables liés au traitement étaient rares, principalement limités à des anomalies hépatiques asymptomatiques, généralement transitoires ou peu évolutives. L’atteinte hépatique des patients ayant reçu cette thérapie génique semblait plutôt liée au mode de vie (consommation d’alcool, obésité). Ces données renforcent le rôle majeur de l’information, de l’éducation et de la surveillance au long cours de ces patients. La progression de la fibrose hépatique chez un patient avec un antécédent de maladie hépatique avancée souligne l’importance d’une évaluation détaillée et d’un suivi hépatique rigoureux. L’absence d’anticorps anti-FIX ou d’événements thromboemboliques est rassurante quant à la tolérance immunitaire.
Bien que cette thérapie génique utilise un AAV recombinant (AAVRh74var), permettant une injection de vecteur 40 fois inférieur à la thérapie génique par etranacogene
dezaparvovec, l’utilisation de corticoïdes était similaire dans les deux études (environ 20 % des patients), sans dépasser un an de traitement (1). L’utilisation d’une dose réduite de vecteur pourrait toutefois réduire le risque d’intégration aléatoire du vecteur et le risque d’effets génotoxiques associés au cancer ainsi que le risque de propagation du vecteur dans les fluides corporels (2,3).
La diminution progressive de l’expression du facteur IX chez certains patients indique la nécessité d’études complémentaires pour optimiser la durabilité de la réponse. En définitive, ces résultats appuient la possibilité d’une thérapie génique unique comme traitement de référence pour l’hémophilie B, dans un contexte de surveillance prolongée pour détecter les potentiels effets indésirables à long terme et pour mieux comprendre la variabilité individuelle de la réponse thérapeutique.
RÉFÉRENCES
1. Pipe SW, Leebeek FWG, Recht M, Key NS, Castaman G, Miesbach W, et al. Gene Therapy with Etranacogene Dezaparvovec for Hemophilia B. N Engl J Med 2023 ; 388 : 706-18.
2. Nguyen GN, Everett JK, Kafle S, Roche AM, Raymond HE, Leiby J, et al. A long-term study of AAV gene therapy in dogs with hemophilia A identifies clonal expansions of transduced liver cells. Nat Biotechnol 2021 ; 39 : 47-55.
3. Favaro P, Downey HD, Zhou JS, Wright JF, Hauck B, Mingozzi F, et al. Host and vector-dependent effects on the risk of germline transmission of AAV vectors. Mol Ther 2009 ; 17 : 1022-30.
CARACTÉRISATION FONCTIONNELLE DE VARIANTS GÉNÉTIQUES DE LA THROMBOMODULINE DÉTECTÉS CHEZ DES PATIENTS AVEC PATHOLOGIES THROMBOTIQUES OU HÉMORRAGIQUES
D’après : Functional assessment of genetic variants in thrombomodulin detected in patients with bleeding and thrombosis. Van Laer C, Lavend’homme R, Baert S,
De Wispelaere K, Thys C, Kint C, et al. Blood 2025 ; 145 : 1929-42.
Actualité commentée réalisée par Alexandre GUY
Justificatifs et objectifs
La recherche de variants génétiques au niveau de gènes codant pour des protéines de la coagulation et de l’hémostase progresse chez les patients avec pathologies thrombotiques et hémorragiques. La recherche de variants au niveau du gène codant la thrombomoduline (TM), THBD, est souvent effectuée. Bien que certaines observations familiales aient rapporté des associations entre des variants de THBD et des pathologies thrombotiques, les études fonctionnelles sur ces variants restent limitées. Cette étude présente l’étude fonctionnelle de 8 variants de THBD mis en évidence chez des patients avec pathologie thrombotique ou hémorragique.
Méthodes
Les auteurs ont réalisé une analyse d’un panel de 30 gènes de la coagulation dans deux cohortes de patients présentant des pathologies thrombotiques ou hémorragiques. à partir des variants de THBD identifiés, les auteurs ont effectué une transfection de cellules endothéliales avec des vecteurs permettant d’apporter l’ADN complémentaire de chaque variant et ont effectué des expériences in vitro permettant de comparer les résultats obtenus avec ces variants et le variant WT : génération de thrombine, activation de la protéine C, activation de l’inhibiteur de la fibrinolyse activée par la thrombine. Enfin, les auteurs ont utilisé un modèle de prédiction de pathogénicité in silico ainsi qu’un modèle de prédiction de structure protéique.
Résultats
Dans cette étude, 601 patients avec suspicion de pathologie thrombotique (n = 294) ou hémorragique (n = 307) ont été analysés. Parmi eux, 6 variants de THBD ont été détectés chez 6 patients avec antécédent de thrombose veineuse. Ont été inclus, dans la suite de l’étude, 2 autres variants de THBD mis en évidence précédemment, dans l’étude Thrombogenomics, chez 2 patients avec symptomatologie hémorragique. La TM soluble inhibant la génération de thrombine, les auteurs ont analysé la génération de thrombine en présence des différents variants de TM recombinante soluble. Alors que 6 variants étaient toujours en mesure d’inhiber la thrombine, la présence des variants L433P et C175S était associée à une absence d’inhibition de la génération de thrombine, avec un effet particulièrement marqué avec le variant L433P.
L’étude de la génération de thrombine en présence des différents variants de TM liée à la membrane, en présence ou non du récepteur endothélial de la protéine C (PC), confirme une absence d’inhibition en présence du variant L433P et une diminution d’inhibition en présence du variant C175S. L’action anticoagulante de la TM via l’activation de la PC par la thrombine a ensuite été évaluée en présence des différents variants de TM soluble ou liée à la membrane. Une diminution significative d’activation de la PC en présence des variants de TM soluble L433P et C175S, et de façon moindre avec le variant G502R, a été observée. La TM permettant aussi une activation de l’inhibiteur de la fibrinolyse activée par la thrombine (TAFI), les auteurs ont ensuite évalué l’effet des différents variants sur le TAFI et ont montré une absence d’activation complète en présence du variant L433P, et une activation ralentie en présence du variant C175S.
L’ensemble de ces résultats démontrent un effet marqué sur les différents rôles de la TM du variant L433P, pour expliquer cet effet, les auteurs ont montré une absence de liaison entre le variant L433P de la TM et la thrombine. Enfin, afin de confirmer les résultats obtenus in vitro, les auteurs ont évalué la pathogénicité des variants étudiés via un modèle de prédiction in silico et un modèle de visualisation protéique 3D qui confirment le caractère probablement pathogène des variants L433P et C175S et permettent de visualiser la perturbation de liaison de la TM avec la thrombine de ces variants.
Avis d’expert
Cette étude révèle l’altération de fonctionnalité de 2 variants de THBD, L433P et C175S, avec une altération particulièrement marquée en présence du variant L433P. Ces deux variants ont été identifiés chez 2 patients avec pathologies thrombotiques d’expression précoce. à noter que ces deux patients avaient également une mutation G20210A du F2, participant donc possiblement au phénotype prothrombotique.
Une étude de ségrégation familiale n’a pu être conduite de manière exhaustive chez ces patients, ce qui constitue une des limites de cette étude. L’étude des 2 variants mis en évidence chez des patients avec symptomatologie hémorragique n’a pas permis (en utilisant des surnageants de cellules transfectées) de mettre en évidence une altération de la génération de thrombine et donc de pouvoir mieux comprendre le rôle de ces variants dans le cadre de pathologies hémorragiques.
Au total, cette étude apporte des éléments clairs d’altération de fonction de la TM chez les patients porteurs de ces variants de THBD et incite donc à inclure la recherche de ces variants dans le bilan de thrombophilie génétique. Cependant, la portée de ces résultats est limitée par la rareté de tels variants et notamment par l’absence de familles porteuses de ces variants décrites jusqu’à présent. Pour exemple, l’étude française publiée récemment par le Dr Suchon (1) retrouvait des variants de THBD chez 2/133 patients, classés de signification incertaine.
RÉFÉRENCES
1. Suchon P, Soukarieh O, Bernard C, Mariotti A, Ernest V, Barthet MC, et al. Assessment of a next generation sequencing gene panel strategy in 133 patients with negative thrombophilia screening. J Thromb Haemost 2025 ; 23 : 997-1008.
ANTICORPS PROTHROMBOTIQUES DIRIGÉS CONTRE LE DOMAINE LIANT LE RÉCEPTEUR DE LA PROTÉINE SPIKE DANS LES INFECTIONS COVID-19 SÉVÈRES
D’après : Prothrombotic antibodies targeting the spike protein’s receptor-binding domain in severe COVID-19. Zhu W, Zheng Y,
Yu M, Witman N, Zhou L, Wei J, et al. Blood 2025 ; 145 : 635-47.
Actualité commentée réalisée par Laure MACRAIGNE
Justificatifs et objectifs
Dans les formes sévères de COVID-19, la thrombo-inflammation joue un rôle majeur dans la morbi-mortalité, avec des complications thrombotiques touchant 20 % des patients en soins intensifs. Chez les patients atteints de COVID-19, les anticorps ciblent la protéine Spike ou son domaine de liaison au récepteur (RBD). En examinant les séquences d’anticorps spécifiques du domaine RBD, les auteurs ont identifié des clones spécifiques qui possèdent un motif RKH ou Y5. Ces motifs ont également été identifiés pour les anticorps anti-FP4/héparine développés chez les patients atteints de thrombopénie induite par l’héparine (TIH). Ainsi, les auteurs ont émis l’hypothèse que l’infection par le SARS-CoV-2 entraîne le développement de certains anticorps spécifiques du virus qui contiennent des caractéristiques structurelles similaires aux anticorps de la TIH capables d’activer les plaquettes.
Méthodes
L’étude porte sur 130 patients hospitalisés atteints de COVID-19. Elle explore le rôle prothrombotique des anticorps anti-RBD et leurs similarités avec les anticorps anti-PF4/héparine.
Résultats
Cette étude montre que 80 % des patients hospitalisés pour une COVID-19 sévère présentent des anticorps IgG qui reconnaissent les complexes PF4/héparine et 41 % d’entre eux induisent une activation plaquettaire en présence de FP4 via le récepteur FcgRIIA. De plus, une corrélation entre les anticorps IgG anti-FP4/H et ceux ciblant le domaine RBD de la protéine Spike a été mise en évidence. à cet égard, l’incubation d’un peptide RBD exogène ou l’élimination des IgG anti-RBD du plasma des patients COVID-19 ont significativement réduit leur capacité à activer les plaquettes. Les auteurs ont également cloné des anticorps spécifiques au RBD capables d’activer les plaquettes à partir de cellules B du sang périphérique de patients COVID-19. Ces anticorps présentaient des motifs de séquence dans la région déterminante de la complémentarité 3 de la chaîne lourde (HCDR3) similaires à ceux identifiés dans les anticorps pathogènes de la TIH.
De plus, chez les patients étudiés, la présence d’anticorps activateurs des plaquettes est associée à une concentration plasmatique plus élevée des protéines plaquettaires telle que le TNFα, le FP4, le PDGF, le CD40L, la P-selectin, le CCL17, et l’interleukin-1α ce qui suggère une pathogénicité de ces anticorps in vivo.
Avis d’expert
Dans cette étude, la présence d’anticorps anti-FP4/H est retrouvée dans près de 80 % des patients étudiés, ce qui confirme les travaux de Liu et al (1). Cependant, ce résultat est nettement supérieur à ceux d’études précédemment publiées, pour lesquels des anticorps anti-FP4/H étaient détectés chez environ 10 à 25 % des patients hospitalisés pour une forme sévère de COVID-19 (2,3).
Tableau 1 : : Caractéristiques des anticorps anti-RBD et des anticorps anti-PF4/H.
Table 1: Characteristics of anti-RBD antibodies and anti-PF4/H antibodies.
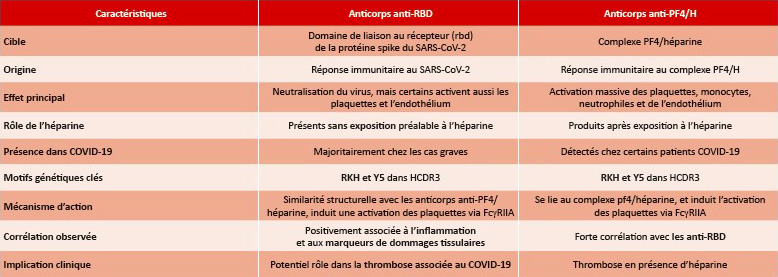
L’infection par le SARS-CoV-2 est accompagnée d’une inflammation importante, ce qui favorise l’activation accrue des cellules B et une production d’anticorps variés, qui peuvent présenter des réactions croisées. à cet égard, il a été montré que les anticorps anti-Spike ne reconnaissent pas le FP4, alors que les anticorps anti-FP4 présentent une certaine réactivité croisée avec le Spike-RBD (4). Cette étude met en évidence la capacité des anticorps dirigés contre le domaine RBD chez les patients atteints de COVID-19 sévères à induire une activation des plaquettes ex vivo. En revanche, aucune association avec la thrombopénie, caractéristique de la TIH, n’a été démontrée. De même, aucun suivi des événements thrombotiques n’a été réalisé, ne permettant pas d’établir de corrélation entre les anticorps activateurs de plaquettes et les thromboses chez les patients atteints de la COVID-19.
Au total, l’étude met en avant les similarités mais également les différences entre les anticorps activateurs de plaquettes observés dans la TIH et dans les formes sévères de COVID-19. De plus, l’impact réel de ces derniers dans la physiopathologie des complications thrombotiques associée à la COVID-19 reste à déterminer plus précisément.
RÉFÉRENCES
1. Liu Q, Miao H, Li S, Zhang P, Gerber GF, Follmann D, et al. Anti-PF4 antibodies associated with disease severity in COVID-19. Proc Natl Acad Sci U S A 2022 ; 119 : e2213361119.
2. Pascreau T, Ballester MC, Van Dreden P, Zia-Chahabi S, Zuber B, Choucair J, et al. The high frequency of anti-PF4/heparin antibodies in patients with COVID-19 is neither related to heparin treatment or to an increased incidence of thrombosis. Clin Chem Lab Med 2021 ; 59 : e405-8.
3. Ueland T, Hausberg I, Mørtberg TV, Dahl TB, Lerum TV, Michelsen A, et al. Anti-PF4/polyanion antibodies in COVID-19 patients are associated with disease severity and pulmonary pathology. Platelets 2022 ; 33 : 640-4.
4. Passariello M, Vetrei C, Amato F, De Lorenzo C. Interactions of Spike-RBD of SARS-CoV-2 and Platelet Factor 4: New Insights in the Etiopathogenesis of Thrombosis. Int J Mol Sci 2021 ; 22 : 8562.

