INTRODUCTION
Les anomalies héréditaires du fibrinogène englobent un groupe hétérogène de déficits qualitatifs et/ou quantitatifs du fibrinogène incluant l’afibrinogénémie, l’hypofibrinogénémie, la dysfibrinogénémie et l’hypodysfibrinogénémie (1). Parmi celles-ci, la dysfibrinogénémie se caractérise par un fibrinogène en concentration normale mais présentant une altération structurelle. Cette anomalie affecte notamment la polymérisation de la fibrine ainsi que les interactions avec la thrombine ou les enzymes de la fibrinolyse. Sa transmission est autosomique dominante, le plus souvent liée à une mutation faux-sens affectant le résidu arginine 35 de l’exon 2 du gène FGA, ou l’arginine 301 de l’exon 8 du gène FGG (2). Le spectre clinique est extrêmement variable, allant d’une tendance hémorragique mineure à des complications majeures, y compris thromboemboliques, bien que de nombreux patients restent asymptomatiques tout au long de leur vie (3).
La grossesse représente une situation clinique particulièrement à risque de complications chez les patientes présentant une dysfibrinogénémie héréditaire. Le fibrinogène joue en effet un rôle essentiel dès les premières étapes de l’implantation placentaire, puis tout au long de la gestation et lors de la délivrance. Il n’est donc pas surprenant que ces patientes soient exposées à diverses complications obstétricales, telles que les fausses couches précoces, les hématomes rétroplacentaires, la vasculopathie placentaire, les saignements vaginaux, ainsi que des événements thrombotiques ou des hémorragies du post-partum. La prise en charge de la dysfibrinogénémie héréditaire durant la grossesse constitue un défi clinique, en raison de l’absence de recommandations fondées sur l’évidence et de la grande hétérogénéité phénotypique de la maladie (4). Elle nécessite une prise en charge multidisciplinaire et individualisée, depuis la conception jusqu’au post-partum. Le recours à un traitement substitutif par concentré de fibrinogène doit être envisagé lors de complications hémorragiques ou à visée prophylactique. En parallèle, le risque thrombotique, bien documenté pour certaines mutations, doit également être pris en compte.
Nous présentons ici le cas d’une patiente atteinte de dysfibrinogénémie héréditaire, ayant mené à terme une grossesse compliquée par plusieurs épisodes hémorragiques, dans le cadre d’un suivi multidisciplinaire rapproché. Ce cas illustre les dilemmes thérapeutiques rencontrés en l’absence de recommandations robustes et met en lumière l’importance d’une stratégie de prise en charge individualisée, fondée sur l’évaluation conjointe des antécédents cliniques, des paramètres biologiques et du contexte obstétrical.
CAS CLINIQUE
Une patiente de 35 ans, avec une dysfibrinogénémie héréditaire diagnostiquée lors d’un screening familial, nous est adressée à la 5e semaine d’aménorrhée (SA) d’une première grossesse en raison de saignements vaginaux. Le bilan biologique initial chez la patiente avait mis en évidence une concentration plasmatique en fibrinogène à 0,6 g/L (méthode de Clauss), 2,8 g/L (méthode dérivée du temps de prothrombine) et 2,4 g/L (immunologique). Le temps de thrombine était à 56 secondes (norme 22 – 28 secondes) et le temps de reptilase à 50 secondes (norme 18 – 22 secondes). Le diagnostic avait été confirmé par analyse génétique, identifiant une mutation hétérozygote Arg35Cys dans le gène FGA (dysfibrinogénémie type 3A selon la classification ISTH). Du point de vue clinique, la patiente présentait un phénotype hémorragique léger caractérisé essentiellement par une tendance à des hématomes cutanés lors de traumatismes mineurs et un saignement prolongé à la suite d’une conisation du col de l’utérus ayant nécessité l’administration d’acide tranexamique. Du point de vue gynécologique, la patiente ne rapportait pas de saignements utérins anormaux (score de Higham de 83 points, en l’absence de contraception). Le score de saignement (ISTH-BAT) était de 4 points. Du point de vue familial, le père, l’oncle du côté paternel et le frère de la patiente, tous asymptomatiques, avaient des concentrations de fibrinogène diminuées. La cousine du côté paternel, aussi connue pour une anomalie du fibrinogène, a eu une 1re grossesse caractérisée par un décollement placentaire à la 40e semaine d’aménorrhée (SA) nécessitant une césarienne en urgence et lors de la 2e grossesse a présenté un saignement vaginal dès la 33e SA traitée par une transfusion de 2 g de fibrinogène (35 mg/Kg) puis des lochies prolongées nécessitant un traitement par acide tranexamique.
Le bilan sanguin effectué lors de la consultation montre une concentration de fibrinogène fonctionnel (méthode de Clauss) à 0,8 g/L et un fibrinogène antigénique à 3,3 g/L. L’échographie ne montre pas d’anomalies fœtales et un saignement vaginal sur un possible hématome rétroplacentaire est évoqué. Une supplémentation en concentré en fibrinogène (3g, 50 mg/kg) est débutée visant une concentration résiduelle de fibrinogène fonctionnel à 1,5 g/L. La substitution est poursuivie 1x/semaine jusqu’à la 12 SA, avec résolution complète des saignements. Le reste de la grossesse se poursuit sans complication avec une croissance fœtale harmonieuse. A 36 SA une consultation multidisciplinaire est organisée avec les anesthésistes, les pédiatres et les obstétriciens et un plan d’accouchement détaillé est établi. Afin de limiter les risques hémorragiques, un accouchement par voie basse est planifié à 39 SA sous anesthésie rachidienne, après l’administration de 4 g (60 mg/Kg) de concentré en fibrinogène. La concentration de fibrinogène fonctionnel mesurée 1 h après la supplémentation est à 1,8 g/L L’intervention se déroule initialement sans incident, mais une hémorragie du post-partum estimée à environ 1 000 mL survient dans les heures suivant l’accouchement, en lien avec une rétention de matériel placentaire. Il n’y a pas d’instabilité hémodynamique ou de coagulopathie manifeste. À ce moment, la concentration de fibrinogène fonctionnel (méthode de Clauss) est de 1,3 g/L, et le taux antigénique atteint 5,2 g/L. La patiente reçoit une dose supplémentaire de 4 g de concentré de fibrinogène (60 mg/Kg) ainsi que 1 gramme d’acide tranexamique. Une révision utérine est réalisée confirmant la rétention de débris placentaires, qui sont évacués manuellement. L’utérus reste tonique après administration d’ocytociques, et aucun geste complémentaire n’est nécessaire. L’évolution est favorable, avec la poursuite d’une supplémentation en fibrinogène 2 g 1x/j pendant 3 jours pour maintenir une concentration résiduelle de fibrinogène > 1,5 g/L et 1 gramme d’acide tranexamique 3x/j pendant 5 jours sans complication secondaire. Une thromboprophylaxie mécanique par bottes de compression mécanique est mise en place. La patiente et le nouveau-né quittent la maternité au cinquième jour.
DISCUSSION
La grossesse chez les femmes atteintes de dysfibrinogénémie héréditaire représente une situation clinique à haut risque, en raison du rôle central du fibrinogène dans les différentes étapes de l’hémostase maternelle et placentaire mais aussi en raison du haut degré de variabilité phénotypique (4).
Les données récentes de la cohorte internationale Fibrinogest ont permis d’objectiver la fréquence des complications obstétricales chez 95 patientes avec dysfibrinogénémie : hémorragie du post-partum dans 20,7 % des cas, fausse couche dans 14,6 %, saignements vaginaux dans 2,6 %, thrombose veineuse dans 0,6 %, hématome rétroplacentaire dans 0,4 % (5). La fréquence des fausses couches précoces n’était pas augmentée par rapport à la population générale, ce qui nuance certaines observations antérieures (6).
La mutation FGA Arg35Cys identifiée chez la patiente est une mutation fréquente, mais qui n’est pas associée de manière statistiquement significative avec un phénotype clinique spécifique. Ce variant du fibrinogène se caractérise par un défaut de polymérisation de la fibrine, expliquant potentiellement une susceptibilité accrue aux saignements, indépendamment du taux antigénique mesuré. Dans une étude antérieure portant sur l’histoire naturelle des dysfibrinogénémies héréditaires, la mutation Arg35Cys n’était pas significativement associée à un risque accru d’hémorragie obstétricale ou de fausse couche (7). Toutefois, il semble que certaines mutations soient spécifiquement corrélées au développement d’une vasculopathie placentaire et de ce fait à des complications obstétricales (6). Il est donc important déjà lors de la consultation pré-conceptionnelle de tenir compte du statut mutationnel de la patiente pour évaluer les risques de la grossesse.
Notre patiente a présenté plusieurs complications hémorragiques. Dans la dysfibrinogénémie, le risque hémorragique n’est pas corrélé au taux de fibrinogène, à la différence de ce qui est observé dans les anomalies quantitatives du fibrinogène (8). Il est donc particulièrement difficile d’évaluer le risque hémorragique. Dans notre cas, une hémorragie du post-partum est survenue malgré une concentration de fibrinogène fonctionnel à 1,8 g/L, confirmant que les seuils habituellement retenus (>1,5 g/L) ne garantissent pas à eux seuls l’absence de complication en présence de facteurs obstétricaux intercurrents (ici, une rétention placentaire). Dans la pratique clinique, un seuil fonctionnel de fibrinogène ≥ 1,5 g/L est couramment utilisé en péripartum pour limiter le risque hémorragique, par analogie avec les seuils recommandés dans les déficits quantitatifs du fibrinogène. Ce seuil repose toutefois sur une base empirique et n’est pas validé spécifiquement pour les dysfibrinogénémies, où l’activité biologique ne reflète pas nécessairement le risque réel de saignement. A noter que la discordance fonctionnelle marquée entre les valeurs d’antigène (5,2 g/L en post-partum) au moment de l’hémorragie souligne que le seul dosage antigénique est insuffisant pour évaluer le risque (9). Le meilleur prédicteur du risque hémorragique en contexte obstétrical semble être l’histoire personnelle de la patiente, plus que les paramètres biologiques isolés (7). C’est sur ces bases qu’a été publiée en 2024 la communication officielle du sous-comité « Facteur XIII et Fibrinogène » de l’ISTH, proposant des principes de prise en charge des grossesses dans les déficits héréditaires en fibrinogène (4).
Ce document, bien qu’il repose principalement sur un consensus d’experts, propose pour les dysfibrinogénémies d’adopter une approche personnalisée basée sur le phénotype hémorragique, les antécédents obstétricaux, ainsi que la mutation identifiée (4). La consultation pré-conceptionnelle constitue un aspect essentiel de la prise en charge. Le mode de transmission autosomique dominant expose à un risque de 50 % pour la descendance, avec une variabilité phénotypique importante. Une information claire sur ce point permet au couple de prendre une décision éclairée et de planifier un suivi néonatal adapté. Durant la grossesse, une surveillance rapprochée est recommandée avec pour objectif une concentration de fibrinogène fonctionnel ≥ 1,5 g/L en période d’accouchement, que ce soit pour une voie basse ou une césarienne. Le recours à l’acide tranexamique est encouragé dans le post-partum immédiat, sauf en cas d’antécédent thrombotique. Dans notre cas, l’ajout d’acide tranexamique, compte tenu du phénotype hémorragique, aurait probablement dû être proposé au moment de l’accouchement. En post-partum, la surveillance clinique doit être prolongée (au moins 72 h), et une thromboprophylaxie pharmacologique est envisagée en cas de substitution prolongée ou de facteurs de risque thrombotique additionnels (Figure 1).
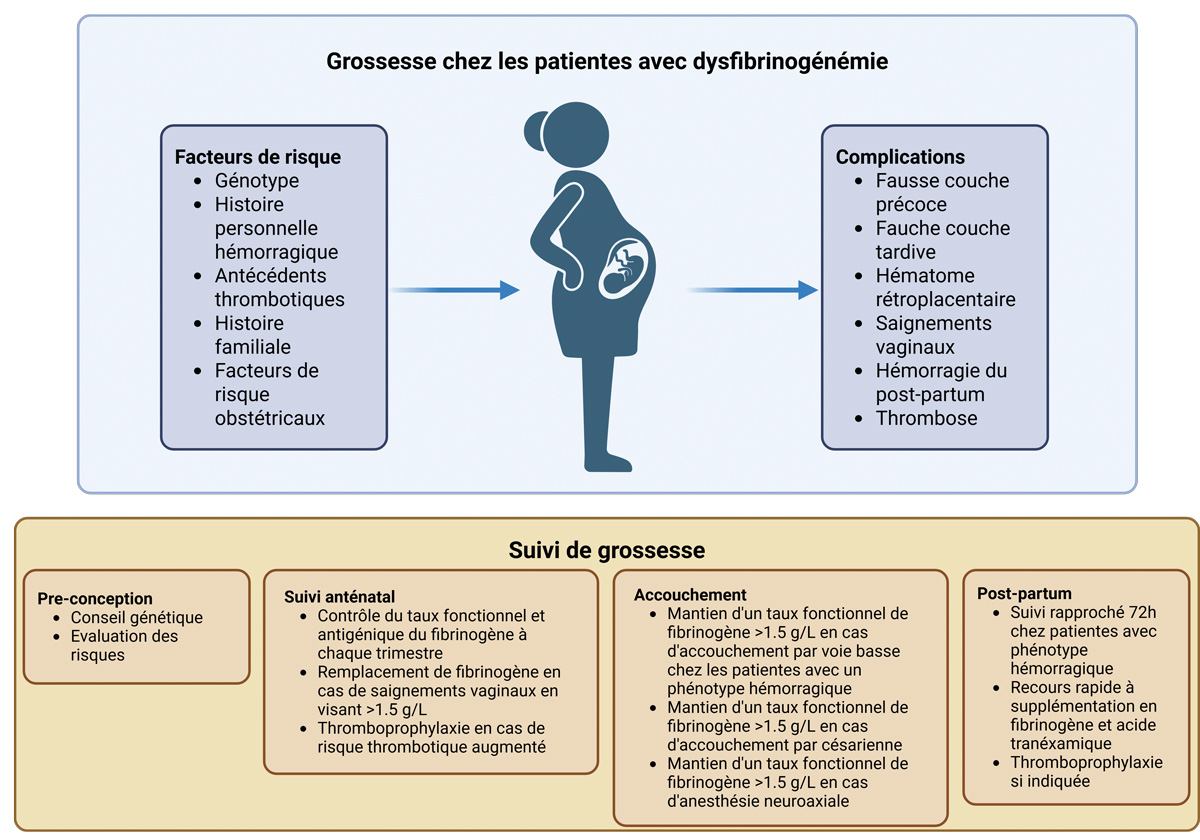
Figure 1 : Grossesse chez les patientes avec dysfibrinogénémie et suivi.
Figure 1: Pregnancy in patients with dysfibrinogenemia and follow-up.
CONCLUSION
Ce cas illustre l’importance d’un suivi soutenu, multidisciplinaire et adapté à chaque situation clinique. L’évaluation conjointe du phénotype, du génotype et des paramètres biologiques permet de guider la prise en charge et de sécuriser le parcours de grossesse. Des efforts de standardisation et des études prospectives restent nécessaires pour affiner les recommandations thérapeutiques dans ce contexte rare.
POINTS CLÉS À RETENIR
• Importance d’un suivi soutenu et multidisciplinaire, adapté à chaque situation clinique.
• Nécessité d’une évaluation conjointe du phénotype, du génotype et des paramètres biologiques pour orienter la prise en charge.
• Cette approche permet de sécuriser le parcours de grossesse dans des contextes hémorragiques rares.
• Des études prospectives sont nécessaires pour affiner les recommandations thérapeutiques.


