Article reçu le 18/07/2025 et accepté le 19/08/2025
Les liens entre les phénomènes de thrombose, d’inflammation et d’immunité innée font l’objet de recherches intensives. L’épidémie de COVID-19 a participé à l’accélération de nos connaissances sur le dialogue moléculaire entre les acteurs des systèmes de la coagulation et de l’immunité innée (1). Ainsi, cibler l’inflammation dans la prévention des événements cardiovasculaires est un concept en pleine émergence (2).
Dans cette rubrique, nous traiterons de l’immunothrombose, et particulièrement des Neutrophils Extracellular Traps (NETs), qui sont au cœur de ce processus. Nous nous pencherons sur leur génération, leur dégradation et la balance qu’ils forment avec les désoxyribonucléases, notamment en situation pathologique comme lors d’une infection par le SARS-CoV2.
LES NETS AU CŒUR DE L’IMMUNOTHROMBOSE ET DE LA THROMBOINFLAMMATION
L’immunothrombose, terme introduit en 2012 par Engelmann et Massberg (3,4), est un processus physiologique au cours duquel la collaboration entre des acteurs du système immunitaire et de l’hémostase joue un rôle quadruple : capturer et retenir les agents pathogènes dans la circulation sanguine et éviter leur dissémination dans l’organisme via le réseau de fibrine, prévenir l’invasiontissulaire par la formation de microthrombi dans les petits vaisseaux, générer un microenvironnement anti-infectieux pour favoriser l’élimination de l’agent pathogène et enfin recruter les cellules immunitaires environnantes afin de coordonner la réponse immunitaire (5) (Figure 1).
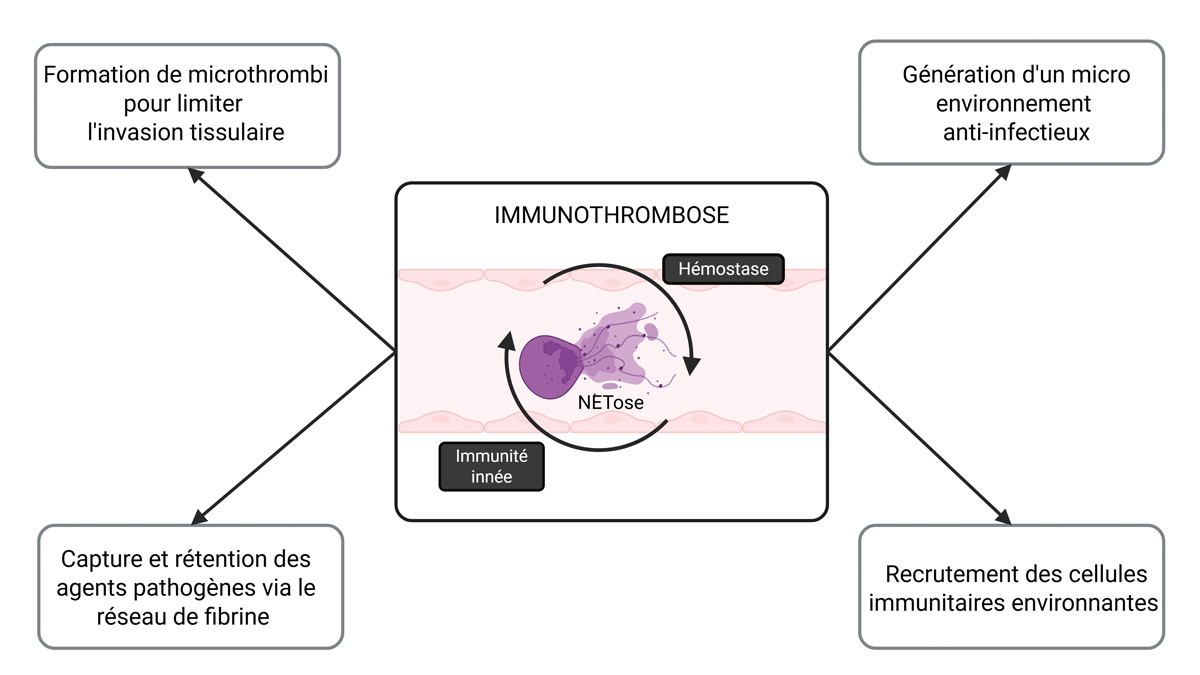
Figure 1 : L’immunothrombose est un processus à l’interface entre l’immunité innée et la coagulation.
Figure 1: Immunothrombosis is a mechanism occurring at the crossroads of innate immunity and blood coagulation
Les NETs jouent un rôle clé lors de l’immunothrombose ; ils sont issus du polynucléaire neutrophile (PNN) et sont composés de filaments d’ADN associés à des protéines nucléaires (histones) et cytoplasmiques (myélopéroxydase, neutrophile élastase). La NETose, le mécanisme de formation des NETs, est un programme actif de mort cellulaire avec des déclencheurs et des mécanismes spécifiques de libération, qui diffère de la nécrose ou de l’apoptose.
Les NETs permettent d’immobiliser et de neutraliser les pathogènes et jouent donc un rôle dans la lutte anti-infectieuse contre les bactéries, les virus et les champignons. Cependant les NETs constituent également une interface essentielle entre la thrombose et l’inflammation : en formant un support pour l’activation des plaquettes et du système de coagulation, ils renforcent leur propriétés prothrombotiques (Figure 2) (2).
On voit donc bien que, physiologiquement, dans le cadre d’une production de NETs appropriée en réponse à un agent infectieux notamment, l’effet de NETs est « bénéfique » : on parle alors d’immunothrombose. Mais si la production de NETs devient excessive, les NETs deviendront délétères via leur activité cytotoxique, pro-inflammatoire et prothrombotique (6) : on parle alors de thromboinflammation. Ainsi les NETs sont impliqués dans la physiopathologie de maladies non infectieuses, comme le cancer et sa progression métastatique, les maladies auto-immunes et la thrombose.
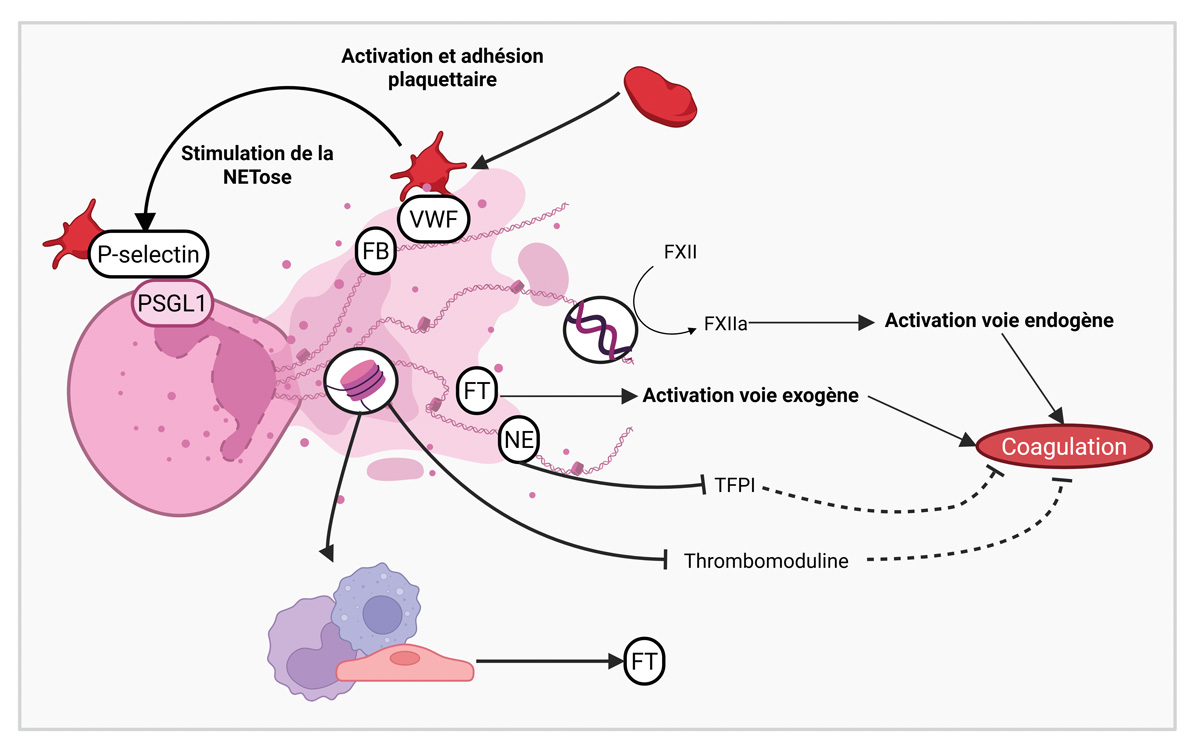
Abréviations : FB : fibrinogène ; VWF : von Willebrand Factor ; FT: facteur tissulaire ; NE : neutrophile élastase.
Figure 2 : Principaux mécanismes prothrombotiques mis en place par les NETs.
Figure 2: Key pro-thrombotic mechanisms induced by NETs.
COMMENT LES NETS ACTIVENT-ILS L’HÉMOSTASE ?
Les NETs sont capables d’activer plusieurs étapes de l’hémostase (Figure 2) (1,2,5) :
1. Ils promeuvent l’activation et l’agrégation plaquettaire notamment via les histones, mais aussi par la liaison des plaquettes au facteur von Willebrand (VWF) et au fibrinogène, présents à la surface des NETs. Il existe une relation bidirectionnelle entre les NETs et les plaquettes puisque ces dernières, une fois activées, sont capables à leur tour de stimuler la NETose, par le biais de la P-sélectine qu’elles expriment et de la protéine HMGB1 qu’elles secrètent (high mobility group box 1).
2. Les NETs activent directement et indirectement la cascade de la coagulation. L’ADN extracellulaire chargé négativement et qui compose les NETs active le facteur XII et par conséquent la voie endogène. En parallèle, des vésicules extracellulaires exprimant du facteur tissulaire (FT) sont retrouvées sur les NETs, activant ainsi la voie exogène. Les histones des NETs sont également capables d’induire l’expression de FT par les cellules endothéliales, les macrophages et les monocytes. Enfin, les complexes ADN/histones stabilisent le réseau de fibrine au sein du thrombus, ce qui augmente le temps de lyse du caillot in vitro.
3. De façon concomitante, les NETs sont capables de dégrader les inhibiteurs de la coagulation. La neutrophile élastase (NE), une enzyme issue des granules des neutrophiles, dégrade le Tissue Factor Pathway Inhibitor (TFPI), et les histones dégradent la thrombomoduline (TM).
COMMENT SONT GÉNÉRÉS LES NETS ?
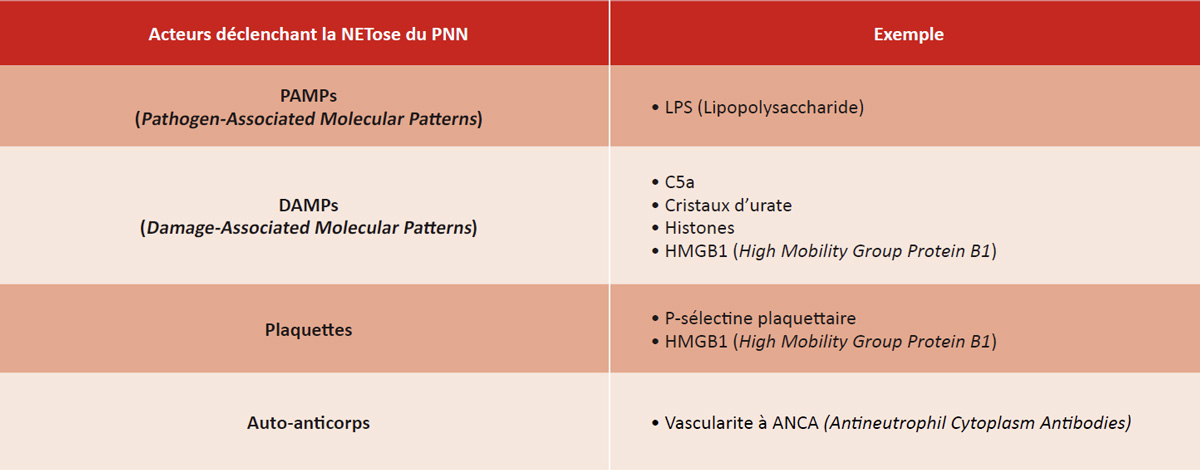
La génération des NETs peut être déclenchée par divers stimuli qui vont activer le polynucléaire neutrophile (Tableau 1). Plusieurs récepteurs exprimés à la surface du polynucléaire neutrophile vont être mis en jeu, comme TLR4 (Toll Receptor 4), RAGE (Receptor for Advanced Glycation End products), C3aR ou PSGL1 (P-selectin glycoprotein ligand 1).
Très récemment, l’équipe de Kolaczkowska a également montré que les NETs eux-mêmes étaient capables de stimuler la production d’autres NETs. En effet, en utilisant un modèle murin d’endotoxémie par une seule injection de LPS, on observait une première vague très rapide de production de NETs, puis une seconde 14 jours après la première sans nouvelle stimulation. Il semble que les NETs restent en fait longtemps dans l’organisme, ce qui contribue à la réexposition d’histones, qui vont stimuler la FSAP (Factor VII Activating Protease), à l’origine de la seconde vague de formation de NETs (7).
Une fois le PNN activé par un des activateurs résumés dans le tableau 1, deux processus majeurs vont avoir lieu dans le PNN : l’augmentation des espèces réactives de l’oxygène (ROS) et l’activation de la peptidylarginine déminase 4 (PAD4), enzyme qui va catalyser la transformation des résidus arginine en citrulline sur certaines histones. Cela va provoquer un changement de charges qui conduit à la décondensation de la chromatine. Par ailleurs, l’augmentation des ROS va également permettre la libération à partir des granules de la myéloperoxydase et de la neutrophile élastase qui vont participer à la décondensation de la chromatine au niveau nucléaire par hydrolyse des histones. La dernière étape est la rupture des membranes nucléaires et cytoplasmiques qui va permettre la libération extracellulaire du NET (5).
Au regard de son implication qui dépasse le cadre de la seule lutte anti-infectieuse, il apparaît fondamental de comprendre et réguler ce phénomène de NETose.
Tableau 1 : Liste non exhaustive des différentes molécules entraînant la génération de NETs par le polynucléaire neutrophile.
Table 1: Non-exhaustive list of molecules that trigger NET formation by neutrophils.
COMMENT SONT DÉTRUITS LES NETS ?
La dégradation des NETs est assurée par des enzymes appartenant à la famille des désoxyribonucléases I (DNases 1). Les DNases 1 sont en effet capables de dégrader l’ADN ou la chromatine issus de cellules en apoptose ou en nécrose, ainsi que les NETs. Plus précisément, ce sont les DNases 1 et 1L3 qui dégradent les NETs, chacune ayant ses spécificités : la DNase 1 possède plus d’affinité pour l’ADN double brin libre, tandis que la DNase 1L3 a plus d’effet sur l’ADN lié à des protéines. Le rôle majeur des DNases 1et 1L3 dans la dégradation des NETs a notamment été montré par le travail de Jiménez-Alcázar et al. : dans des modèles murins déficients DNase 1 et en DNase 1L3, l’induction d’une polynucléose neutrophile, non délétère pour des souris normales, avait pour conséquence une obstruction vasculaire diffuse léthale chez celles déficitaires en ces enzymes (6).
Les cellules productrices des DNases sont les cellules dendritiques plasmacytoïdes (pDC) et les cellules dendritiques pour la DNase 1L3, tandis que la DNase 1 est plutôt exprimée de façon ubiquitaire dans l’organisme, avec une expression faible par les cellules sanguines (8).
Les DNases ne sont cependant pas le seul mécanisme
responsable de la dégradation des NETs. L’utilisation de la DNase à concentration physiologique ne dégrade
d’ailleurs que partiellement les NETs (5,9). Santocki et al. ont récemment montré que les cellules de Kupffer et les polynucléaires neutrophiles étaient capables de phagocyter les NETs après opsonisation, dans le foie (7).
EXEMPLE DU COVID ET DÉRÉGULATION DE LA BALANCE NET/DNASE
La balance entre la formation et la dégradation des NETs est primordiale, particulièrement lors d’un contexte pathologique. L’épidémie de COVID-19 en est une illustration frappante. La présence d’une coagulopathie biologique, et la mise en évidence de thrombose des gros vaisseaux, mais aussi des petits vaisseaux notamment pulmonaires sur autopsie post-mortem, et de cathéters malgré une
anticoagulation préventive, ont rapidement fait suspecter la thromboinflammation comme mécanisme central dans la physiopathologie des formes graves (5).
De nombreux arguments sont en faveur de l’implication des NETs lors d’une infection COVID-19. En effet, les marqueurs des NETs comme le cfDNA, le MPO-DNA et l’H3Cit augmentent au cours de la maladie et leur concentration est d’autant plus élevée que la maladie est sévère (besoin en 02, mise en place d’une ventilation mécanique, présence d’un SDRA) et que la mortalité augmente (5,10-13). Ils se normalisent chez le sujet convalescent avec des niveaux comparables à ceux de sujets sains (5,11,13). Par ailleurs, les PNNs isolés de patients atteints de COVID-19 forment spontanément plus de NETs que ceux de sujets sains (5,12,13).
Un des mécanismes pouvant expliquer cette augmentation majeure des NETs chez les patients les plus graves était un défaut de régulation de leur concentration par les DNases. Garcia et al. (8) se sont ainsi intéressés à la balance entre les marqueurs de NETs et les DNases au cours de la maladie.
Dans une cohorte de patients sains et de patients atteints de COVID-19 classés non sévères, sévères ou critiques, le ratio entre la production et la dégradation des NETs était plus élevé chez les patients les plus sévères. Les patients critiques avaient notamment une quantité de DNase 1 plus faible que les patients non sévères. Les DNases circulantes ne sont ainsi pas suffisamment up-régulées pour éliminer les NETs formés chez les patients en état sévère ou critique. D’autres mécanismes ont été associés à une diminution de l’élimination des NETs au cours de la COVID-19 : la présence d’anticorps anti-NET pouvant empêcher leur clairance (14), la présence d’anticorps anti-DNase 1L3 (15) ou encore l’augmentation de l’actine G, qui est un inhibiteur de la DNase 1 (15,16).
De nombreuses questions persistent encore autour de la régulation et du rôle des NETs dans la physiopathologie de la COVID-19. Malgré de multiples associations entre les marqueurs de NETs et différents paramètres de gravité de la maladie, il est pour le moment difficile de conclure formellement si l’excès de NETs est responsable de l’aggravation de la maladie ou si c’est une conséquence et un marqueur de gravité de la maladie. Par ailleurs, la question de savoir si la réduction de la quantité de DNase est spécifique au COVID-19 reste ouverte, puisque cela pourrait être un mécanisme partagé lors d’infections sévères (5).
PERSPECTIVES : LA DNASE COMME TRAITEMENT ?
La NETose a donc des effets bénéfiques lors les étapes précoces d’une infection mais des mécanismes de régulation sont essentiels pour éviter la thromboinflammation et les dommages tissulaires induits par les NETs. Les DNases sont donc des enzymes clés pour maîtriser ce risque induit par la persistance des NETs et elles ont, par conséquent, été testées comme agent thérapeutique.
Il existe actuellement sur le marché la Dornase alfa, une DNase 1 recombinante humaine indiquée contre l’encombrement bronchique dans la mucoviscidose, uniquement par voie inhalée. Une étude randomisée contrôlée chez 76 patients a été menée sur l’utilisation de cette thérapie chez des patients atteints de COVID-19, hypoxiques et admis en hospitalisation, sans efficacité notable (17). Cependant la voie d’administration était inhalée, or les capillaires de ces patients étaient vraisemblablement thrombosés, ne permettant pas la diffusion systémique de la DNase. Des essais sont actuellement menés dans le sepsis et la thrombose artérielle en administrant la DNase par voie intraveineuse. L’étude IDEALSepsis I évalue la faisabilité et l’innocuité de l’administration de DNase 1 chez des patients en sepsis. Pour la thrombose artérielle, l’étude EXTEND-IA DNase NCT05203224 investigue l’amélioration de la reperfusion précoce dans l’AVC ischémique des gros vaisseaux et l’étude NETs-target NCT04785066 étudie l’efficacité de la DNase 1 sur la recanalisation artérielle chez les patients après thrombectomie au décours d’un AVC ischémique. Les résultats de ces études nourrissent l’espoir de nouvelles perspectives quant à l’utilisation potentielle de la DNase en tant qu’agent thérapeutique.
La compréhension des mécanismes d’immunothrombose et des liens entre l’inflammation et la coagulation, et particulièrement l’implication des NETs, est un enjeu important pour ouvrir la voie à de nouvelles approches thérapeutiques. La NETose n’est pas seulement un mécanisme de défense anti-infectieux, elle joue un rôle central qui reste encore à élucider complètement, notamment dans des pathologies comme la COVID-19. L’avenir pourrait résider dans une modulation plus fine de la NETose, capable de préserver son potentiel anti-infectieux tout en limitant son impact dans la thromboinflammation.
POINTS CLÉS À RETENIR
• L’immunothrombose désigne une réponse physiologique intégrée entre l’immunité innée et la coagulation, permettant de piéger les agents pathogènes tout en limitant leur dissémination.
• Les Neutrophil Extracellular Traps (NETs), issus des polynucléaires neutrophiles, jouent un rôle central dans l’immunothrombose en capturant les pathogènes grâce à des filaments d’ADN associés à des protéines cytotoxiques. Ils peuvent également favoriser la coagulation en activant les plaquettes, en stimulant les voies endogène et exogène de la coagulation, et en inhibant les mécanismes anticoagulants physiologiques.
• Lorsque la NETose devient excessive ou mal contrôlée, ces structures peuvent induire une réponse inflammatoire et prothrombotique, appelée thromboinflammation.
• La formation des NETs dépend de signaux spécifiques impliquant l’enzyme PAD4, qui déclenche la décondensation de la chromatine et la libération extracellulaire du contenu nucléaire.
• Les DNases 1 et 1L3 assurent la dégradation des NETs, mais leur activité peut être insuffisante dans certaines conditions pathologiques, comme les formes graves de COVID-19. La balance entre les NETs et les DNases est alors altérée.
• Des approches thérapeutiques utilisant la DNase recombinante sont en cours d’évaluation pour limiter les complications liées au phénomène de thromboinflammation.




