RÉSUMÉ
Le Groupe d’Intérêt en Hémostase Péri-opératoire (GIHP) et la Société Française de Thrombose et d’Hémostase (SFTH) ont élaboré des propositions de prise en charge des hémorragies et des procédures invasives chez les patients traités par des anticoagulants ciblant le facteur XI ou XIa (anti-FXI(a)). Ces agents anti-FXI(a), ayant des mécanismes d’action et des propriétés pharmacologiques distincts, sont actuellement encore en développement clinique. Néanmoins, il est nécessaire d’anticiper la gestion du risque hémorragique chez les patients déjà inclus dans les essais cliniques car ces patients peuvent être confrontés à des procédures invasives ou présenter des événements hémorragiques. La prise en charge des patients présentant un déficit héréditaire en FXI, et l’expérience des premiers essais cliniques, suggèrent que le risque hémorragique lié aux anti-FXI(a) est probablement faible mais peut varier selon la situation clinique. Les options de réversion des anti-FXI(a) comprennent l’acide tranexamique, les concentrés de FXI et le facteur VIIa recombinant activé. Toutefois, ces options théoriques ne sont pas toujours adaptées aux différentes situations, peuvent être coûteuses et exposent potentiellement à un risque thrombotique. Nous proposons des recommandations pragmatiques visant à optimiser la sécurité des patients traités par anti-FXI(a), en tenant compte des risques hémorragiques et thrombotiques, du mécanisme d’action du médicament et des options de réversion disponibles. Ces propositions seront réévaluées à mesure que de nouvelles données seront publiées. La mise en place d’un registre dédié à la prise en charge des anticoagulants anti-FXI(a) chez les patients devant bénéficier de procédures invasives ou présentant des complications hémorragiques est nécessaire.MOTS CLÉS
anti-facteur XI(a), hémorragie, procédures invasives, recommandations, réversion
ABSTRACT
The French Working Group on Perioperative Haemostasis (Groupe d’Intérêt en Hémostase Péri-opératoire (GIHP)) and the French Society of Thrombosis and Haemostasis (SFTH) have developed proposals to manage bleeding and invasive procedures in patients treated with anticoagulants targeting Factor XI or XIa (anti-FXI(a)). Several anti-FXI(a) agents with distinct mechanisms of action and pharmacological properties are currently under clinical development. While these anticoagulants are not yet available, there is a need to address bleeding risk management for patients already enrolled in phase III trials. These patients may face elective or unplanned invasive procedures and bleeding events in anticipation of marketing authorization. Experience from managing patients with inherited FXI deficiency, along with data from early clinical trials, suggest that the bleeding risk associated with anti-FXI(a) is likely to be low but can vary depending on the clinical situation. Anti-FXI(a) reversal options include tranexamic acid, FXI concentrates, and recombinant activated factor VII. However, these options may not always be suitable, can be expensive, and may carry a thrombotic risk. We propose pragmatic recommendations for optimizing safety in patients treated with anti-FXI(a), considering bleeding and thrombosis risks, the drug mechanism of action, and available reversal options. These proposals will be re-evaluated as more data become available. The implementation of a registry for managing anti-FXI(a) anticoagulants in patients undergoing invasive procedures or experiencing bleeding complications is needed.
KEYWORDS
anti factor XI (a), bleeding, guidance, invasives procedures, reversal
INTRODUCTION
Les anticoagulants jouent un rôle clé dans la prévention et le traitement des événements thromboemboliques artériels et veineux. Cependant, dans leurs principales indications – comme la prévention de l’AVC en cas de fibrillation atriale (FA) ou le traitement de la maladie thromboembolique veineuse (MTEV) – le risque hémorragique inhérent à ces traitements, y compris aux anticoagulants oraux directs (AOD), limite leur prescription chez une proportion importante de patients qui pourraient en bénéficier.
L’inhibition de la voie du facteur XI (FXI) est une option prometteuse, car ce facteur est important pour la thrombose mais ne joue qu’un rôle mineur dans l’hémostase. Des anticoagulants ciblant le FXI ou le FXIa (anti-FXI(a)) ont donc été développés dans l’objectif d’une activité antithrombotique au moins aussi efficace que celle des AOD anti-IIa ou anti-Xa, mais avec un risque hémorragique significativement plus faible.
Le FXI intervient dans l’hémostase physiologique en contribuant au renforcement du caillot. Après une lésion vasculaire, le complexe facteur tissulaire FVIIa initie l’activation de la cascade des protéases de la coagulation, conduisant à un burst de génération de thrombine et à la formation de fibrine. La boucle de rétro-amplification, en particulier via le FXI activé par la thrombine, renforce et consolide la formation du caillot. Par ailleurs, une forte concentration de thrombine contribuerait à protéger le caillot d’une lyse prématurée par l’activation du
Thrombin-Activable Fibrinolysis Inhibitor (TAFI) (1).
À l’inverse, dans la thrombose, l’activation du FXI est cruciale pour la propagation du caillot au-delà du site initial de la lésion, conduisant à la formation d’un thrombus. La phase contact peut être activée au contact d’un endothélium lésé, d’une plaque d’athérosclérose rompue, de cellules activées ou de vésicules extracellulaires, ainsi que de surfaces artificielles. Le FXI fait le lien entre la phase contact et la ténase intrinsèque, étant activé par le FXIIa puis activant à son tour le FIX en FIXa (1). Le FXI peut également être activé par la thrombine via les boucles d’amplification contribuant ainsi à la formation du thrombus.
Le facteur XI se fixe aussi de manière spécifique et réversible sur des sites de haute affinité (Kd 10-⁸ M) à la surface des plaquettes activées, ce qui favorise son activation par la thrombine. Les plaquettes activées sécrètent des polyphosphates qui potentialisent l’activation du FXI
par la thrombine (multiplication par 3000), rendant cette réaction de rétroactivation physiologiquement essentielle pour maintenir une génération soutenue de thrombine.
De plus, un FXI plaquettaire a été décrit comme produit d’épissage alternatif du gène du FXI, spécifiquement exprimé dans les mégacaryocytes et les plaquettes. Fait intéressant, ce FXI plaquettaire fonctionnellement actif est exprimé de manière différentielle sur les membranes plaquettaires de façon spécifique aux tissus, à la fois de manière constitutive et de manière dépendante de la concentration par divers agonistes, en l’absence de FXI plasmatique détectable (2). Ceci pourrait contribuer à la faible corrélation entre le taux plasmatique de FXI et le phénotype hémorragique observé dans le déficit héréditaire en FXI. En effet, même dans les formes avec déficit majeur en FXI, le déficit constitutionnel en FXI se traduit par une tendance hémorragique modérée, principalement localisée dans les zones où le système fibrinolytique est très actif (cavité buccale, voies aériennes supérieures, appareil urinaire). À l’inverse, le risque thrombotique est diminué, en particulier pour la MTEV et l’AVC (3).
Plusieurs stratégies ont été proposées pour inhiber le FXI et/ou le FXIa, dont trois sont actuellement en développement clinique avancé : les oligonucléotides antisens (ASO), les anticorps monoclonaux (mAb) et les petites molécules.
Ces classes thérapeutiques diffèrent par leurs mécanismes d’action et leurs propriétés pharmacologiques. Les données des études de phase II et III confirment un faible risque hémorragique, mais l’efficacité antithrombotique en FA reste débattue, en particulier pour la petite molécule asundexian. Néanmoins, il est probable (au moment de la rédaction) que ces anticoagulants, ou au moins certains d’entre eux, arrivent sur le marché dans les prochains mois ou années.
Une proportion significative de patients traités par anti-FXI(a) sera inévitablement exposée à des situations critiques : hémorragies spontanées ou traumatiques, chirurgie programmée ou en urgence, autres procédures invasives. Malheureusement, les données concernant les patients inclus dans les essais évaluant ces anticoagulants et exposés à des procédures invasives ne sont pas encore complètement disponibles. Les données récemment présentées de l’essai AZALEA-TIMI 71, évaluant l’abélacimab en FA, rapportent les complications hémorragiques péri-procédurales (4). Environ 35 % des patients ont eu au moins une procédure invasive pendant l’étude, dont un quart non programmées. Si le taux global de saignement lié aux procédures était faible, plus des trois quarts des actes étaient à faible risque hémorragique et correspondent à des procédures souvent réalisées sans arrêt de l’anticoagulation (par exemple coronarographie). Néanmoins, parmi les rares patients ayant bénéficié de procédures à haut risque hémorragique, ceux traités par abélacimab ont présenté un pourcentage plus élevé de complications hémorragiques que ceux sous rivaroxaban (4,7 % contre 0).
Les premières expériences de chirurgie non programmée et de complications hémorragiques chez des patients inclus dans des essais de phase III, bien que survenues et prises en charge dans des centres experts, montrent que les protocoles préconisés dans les essais cliniques sont imprécis (4). Cette expérience limitée met également en évidence d’importantes lacunes dans la connaissance des meilleures stratégies de prise en charge, notamment pour l’évaluation du risque hémorragique, le bilan biologique et les modalités de restauration de l’hémostase ou de réversion de l’effet anti-FXI(a) (4).
Bien que certains groupes d’experts aient abordé ces questions et publié des textes de propositions de prise en charge, de nombreux aspects restent à préciser pour proposer des conduites à tenir adaptées, pragmatiques et soutenables (3,5). Il s’agit en outre d’une nouvelle classe d’agents antithrombotiques, avec des molécules aux mécanismes d’action et aux propriétés pharmacologiques très différents, ce qui rend nécessaire l’élaboration de protocoles de prise en charge clairs et pratiques, appelés à être réévalués.
Dans le cadre d’une démarche de risk management et en anticipation d’une future autorisation de mise sur le marché, des consultations ont été menées au sein du GIHP et du groupe TITANs (Thrombosis, antIcoagulanTs and ANtiplatelet agents) de la SFTH concernant la gestion du risque hémorragique chez ces patients.
Une première version de propositions, basée sur les recommandations pour les patients avec déficit héréditaire en FXI (6), a été adaptée aux anti-FXI(a) en s’appuyant sur les études pharmacologiques et sur les résultats des essais de phases I et II. Le texte a ensuite été soumis aux membres du GIHP et de la SFTH pour plusieurs tours de relecture critique jusqu’à l’obtention d’un consensus, présenté ci-dessous.
PROPOSITIONS
Examens biologiques
Tous les anticoagulants anti-XI(a) prolongent le temps de céphaline activée (TCA) (7). Cependant, la sensibilité des TCA (dépendant du couple réactifs/automates) au déficit en FXI est très variable en raison de compositions différentes en activateur de contact et en phospholipides. Il est probable que cette variabilité soit la même pour tout anticoagulant anti-FXI(a), comme cela a déjà été montré pour le milvexian. De plus, il est nécessaire de rappeler que le TCA présente de nombreuses limites en termes de pertinence clinique pour estimer le risque hémorragique.
Le dosage du FXI:C (test de coagulation), dont le délai de rendu va d’une à quelques heures selon le laboratoire, peut être utile pour documenter un faible taux plasmatique lié à une diminution de synthèse (ASO). Il est en revanche inutile avec les autres anti-FXI(a) (mAb, petites molécules), qui ne sont pas censés abaisser le taux plasmatique de FXI mais peuvent interférer avec le dosage du FXI et d’autres facteurs de coagulation. Il est donc recommandé d’effectuer les dosages de facteurs à plusieurs dilutions du plasma patient afin de contourner un éventuel effet inhibiteur et d’éviter les erreurs d’interprétation.
La génération de thrombine a été évaluée in vitro, dans certaines études de développement des anti-FXI(a), dans des conditions très spécifiques, mais n’a pas de place en pratique clinique courante.
Concernant les tests au lit du malade (point-of-care) – temps de coagulation activée (ACT) ou tests viscoélastométriques – les données disponibles sont trop limitées pour conclure sur l’impact des anti-FXI(a).
Même si des données supplémentaires sont nécessaires pour mieux préciser les indications de ces examens, les tests actuellement disponibles peuvent néanmoins aider à la prise en charge péri-opératoire ou lors de situations hémorragiques chez des patients recevant des anti-FXI(a), de la façon suivante :
• Un TCA normal suggère une absence ou un faible défaut en FXI, à condition de connaître la sensibilité du TCA utilisé localement ;
• Chez les patients sous ASO, nous proposons de doser le FXI plasmatique, même si ce dosage n’est pas disponible en continu partout. Il doit être utilisé de la même façon, avec les mêmes limites, que dans le déficit héréditaire en FXI. Pour les autres anti-FXI(a), la mesure du FXI semble de peu d’intérêt et peut même être trompeuse du fait d’interférences analytiques ;
• Les examens courants non influencés par les anti-FXI(a) comprennent : TP-INR, fibrinogène (méthode de Clauss) et D-dimères.
Prise en charge du risque hémorragique : du déficit héréditaire en FXI aux anticoagulants anti-facteur XI(a)
Prise en charge du risque hémorragique dans le déficit héréditaire en FXI
La stratégie de prise en charge du risque hémorragique sous anti-FXI(a) est extrapolée à partir de l’expérience chez les patients présentant un déficit héréditaire modéré ou sévère en FXI et ayant subi une intervention chirurgicale ou présenté des hémorragies. Malgré une hétérogénéité clinique importante, ces patients ont rarement de saignements spontanés mais présentent un risque accru d’hémorragie péri-opératoire. La tendance hémorragique est généralement modérée, moindre que dans l’hémophilie, et varie selon le site opératoire : elle est faible en chirurgie osseuse et plus marquée dans les sites à forte activité fibrinolytique comme l’ORL (nez, cavité buccale) et l’appareil urogénital. Comme indiqué plus haut, l’analyse isolée du taux résiduel de FXI, du TCA ou du génotype ne permet pas de prédire le risque hémorragique.
Une chirurgie réalisée sans prophylaxie chez des patients ayant un déficit en FXI est associée à une forte incidence de complications hémorragiques (1). La prise en charge pharmacologique repose donc principalement sur l’acide tranexamique (TXA), ajusté en cas d’insuffisance rénale, le facteur VIIa recombinant humain activé (rFVIIa), les concentrés de FXI (Hemoleven®) et/ou le plasma frais congelé (PFC) (6). Le TXA est largement utilisé, car le déficit héréditaire en FXI s’accompagne d’une sensibilité accrue à la fibrinolyse. Compte tenu du caractère généralement modéré du risque hémorragique, ce dernier peut souvent être contrôlé par le TXA seul. Les doses recommandées sont de 15-20 mg/kg ou 1 g quatre fois par jour pendant 5 à 7 jours.
Pour les chirurgies à haut risque de saignement, deux options sont possibles : rFVIIa ou concentrés de FXI (Hemoleven®). Le PFC (15-20 mL/kg) peut constituer une alternative en l’absence de concentré de FXI. Le choix dépend à la fois de l’état clinique du patient, de l’expérience de l’équipe et de la disponibilité des concentrés de FXI dans le pays ou le centre concerné. L’administration de faibles doses de rFVIIa (10-15 µg/kg en dose unique) associées au TXA semble être la pratique la plus fréquente, en raison de la disponibilité du produit et de l’absence de signal thrombotique rapporté à ce jour (8). Cette stratégie permet de contourner le déficit en FXI et d’augmenter la résistance à la fibrinolyse, la thrombine générée potentialisant l’activation du TAFI.
À l’inverse, bien que la supplémentation en FXI paraisse logique pour corriger un déficit, l’utilisation de concentrés de FXI a été associée à des événements thrombotiques, conduisant à des recommandations spécifiques : suivi du traitement par Hemoleven® par un spécialiste de
l’hémostase, calcul de la dose pour atteindre un taux cible de FXI entre 30 et 40 % (0,3-0,4 UI/mL, 1 % correspondant à 0,01 UI/mL, soit 1 U/dL) chez les patients sévèrement déficitaires (FXI < 20 %), en considérant un rendement moyen d’environ 2 %/UI/kg ; dose initiale recommandée de 10–15 UI/kg, sans dépasser 15 UI/kg et en réévaluant la situation avant toute nouvelle injection ; absence de réinjection dans les 24 heures (9).
D’autres options thérapeutiques ont été rapportées, notamment l’utilisation de PFC, dans les pays où les concentrés de FXI ne sont pas disponibles. Cette approche impose toutefois la transfusion de volumes importants. En dehors de quelques observations isolées, il n’existe pas de données sur l’utilisation de la desmopressine, de l’aPCC ou du PCC ; ces deux derniers ont été proposés comme alternatives pour contourner l’inhibition de FXI(a) lorsque le rFVIIa et le FXI ne sont pas disponibles, le PCC étant alors à privilégier.
Propositions de prise en charge des patients traités par anticoagulants anti-facteur XI(a)
La transposition des données du déficit héréditaire en FXI au contexte des anticoagulants anti-FXI(a) nécessite prudence et prise en compte du mécanisme d’action de chaque molécule. Les points clés suivants aident à définir la conduite à tenir :
• Le risque hémorragique sous anti-FXI(a) est probablement inférieur à celui des autres anticoagulants ;
• L’arrêt pré-opératoire du traitement ne se justifie que pour les molécules à demi-vie courte, c’est-à-dire les petites molécules. En conséquence, la majorité des procédures programmées ou non sont réalisées sous anticoagulation pour les ASO et mAb ;
• Aucun antidote spécifique n’est actuellement disponible, même si des développements sont en cours ;
• Les concentrés de FXI ne sont envisageables que chez les patients traités par ASO, situation qui mime le mieux un déficit sévère/complet en FXI ; ils sont inefficaces pour les molécules ciblant directement FXI(a) ou inhibant FXI de manière saturante ;
• Le TXA, et éventuellement le rFVIIa, qui ne ciblent pas spécifiquement FXI, peuvent être utilisés quel que soit l’anti-FXI(a). Les posologies proposées sont celles du déficit en FXI.
Les données préliminaires de l’essai AZALEA-TIMI 71 (4) nous ont conduits à proposer les deux algorithmes présentés aux figures 1 et 2.

Figure 1 : Procédures invasives chez les patients traités par des anticoagulants anti-facteur XI(a).
Figure 1: Invasive procedures in patients treated with anti-factor XI(a) anticoagulants.
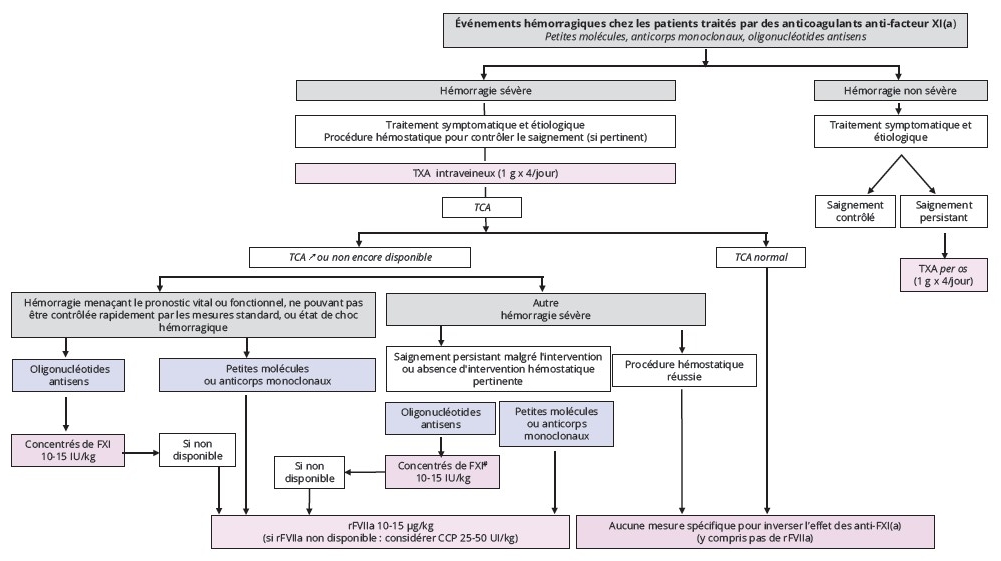
Figure 2 : Événements hémorragiques chez les patients traités par des anticoagulants anti-facteur XI(a).
Figure 2: Hemorrhagic events in patients treated with anti-factor XI(a) anticoagulants.
Procédures invasives chez les patients traités par anticoagulants anti-facteur XI(a) (Figure 1)
Risque hémorragique faible
Pour les procédures à faible risque de saignement (extractions dentaires, libération de canal carpien, biopsies gastriques ou coliques, etc.), compte tenu de l’augmentation de la sensibilité à la fibrinolyse induite par les anti-FXI(a), un court traitement par TXA est proposé, soit en prophylaxie, soit uniquement en cas de saignement anormal, selon la procédure et le risque hémorragique évalué.
Risque hémorragique élevé
Procédures programmées
Pour les procédures à risque hémorragique élevé, l’expérience du déficit en FXI suggère que les complications doivent être prévenues (6,10). Les moyens d’optimiser l’hémostase dépendent de l’anti-FXI(a) utilisé et de ses caractéristiques.
L’arrêt de l’anticoagulant avant une procédure programmée n’est possible que pour les petites molécules comme le milvexian ou l’asundexian, dont les demi-vies sont respectivement de 11-18 h et 16-18 h. Les données pharmacologiques montrent qu’à 48 h après la dernière prise, les concentrations sont inférieures à 10 % du Cmax pour des doses de 25 à 100 mg d’asundexian et de 20 à 200 mg de milvexian. Ainsi, un arrêt à J–3 avant la chirurgie peut être proposé.
Compte tenu de la longue demi-vie des mAb et des ASO et de leur effet anticoagulant persistant plusieurssemaines, l’arrêt n’est pas une option : la plupart des chirurgies seront donc réalisées chez un patient anticoagulé. Dans ce cas, nous proposons l’utilisation systématique de TXA (Figure 1). Pour les mAb, si la procédure peut être repoussée juste avant l’injection suivante, le risque hémorragique pourrait être partiellement réduit.
Si l’augmentation du risque hémorragique induite par l’anti-FXI(a) est jugée inacceptable, une réversion doit être envisagée, en pondérant le bénéfice hémostatique et le risque thrombotique du traitement de réversion :
• pour les mAb, le rFVIIa est proposé ;
• pour les ASO, la réduction des taux de FXI induite par le médicament est très variable et peut être inférieure à 0,1 UI/mL (10 %). Dans ce contexte, les concentrés de FXI sont proposés selon les mêmes protocoles que pour le déficit héréditaire, ces molécules diminuant fortement le FXI. Le risque thrombotique lié aux concentrés de FXI doit être pris en compte, bien qu’il soit mal connu chez ces patients souvent à risque cardiovasculaire. Le suivi des taux de FXI avant et après administration est primordial pour les procédures nécessitant une hémostase optimale sur plusieurs jours (neurochirurgie, chirurgie urologique complexe…) afin d’identifier les rares cas où une réinjection serait nécessaire après le premier jour (au vu d’une demi-vie d’environ 48 h, aucune réinjection ne doit être faite avant 24 h). Le rFVIIa constitue l’alternative aux concentrés de FXI.
Procédures invasives non programmées
La prise en charge des procédures non programmées dépend de l’anti-FXI(a) en cours, du risque hémorragique de la procédure et du TCA. Chez les patients traités par petites molécules inhibitrices ou mAb, le rFVIIa et le TXA peuvent être proposés pour améliorer l’hémostase, sans indication pour les concentrés de FXI. Chez les patients traités par ASO, des concentrés de FXI ou le rFVIIa, associés au TXA, peuvent être utilisés.
Le risque hémorragique péri-opératoire sous anti-FXI(a) et la tolérance du rFVIIa et des concentrés de FXI restent mal documentés, que ce soit pour des procédures programmées ou non. Il est donc proposé de ne pas administrer systématiquement rFVIIa ou concentrés de FXI en pré-opératoire, mais de réserver ces traitements aux situations où une correction pré-opératoire de l’hémostase est indispensable, par exemple lorsque la procédure concerne des organes ou tissus où une hémorragie aurait des conséquences fonctionnelles majeures, ou en cas de saignement difficilement contrôlable par les moyens chirurgicaux (neurochirurgie, chirurgie complexe). Dans ce cas, le rFVIIa ou concentrés de FXI seront administrés avant la procédure. À l’inverse, lorsque les saignements peuvent être surveillés et maîtrisés pendant l’intervention, l’administration de rFVIIa ou de concentrés de FXI devrait être limitée aux situations de saignement anormal documenté.
Même si la relation dose-effet sur le TCA doit être précisée pour chaque molécule, un TCA normal permet en pratique d’exclure des concentrations élevées d’anti-FXI(a), quelle que soit la molécule, et d’opter pour une prise en charge standard.
Prise en charge des hémorragies chez les patients traités par anticoagulants anti-facteur XI(a) (Figure 2)
La prise en charge dépend de la sévérité du saignement.
Les hémorragies non sévères sont traitées de façon symptomatique et étiologique sans correction systématique de l’hémostase. En cas de persistance du saignement, l’administration de TXA est suggérée.
À l’inverse, en cas d’hémorragie sévère, les traitements symptomatiques et étiologiques sont systématiquement associés au TXA. La durée de ce traitement n’est pas clairement établie, mais pourrait être de plusieurs jours, en particulier lorsqu’il est utilisé seul et chez les patients sous ASO.
Le TCA guide la prise en charge : un TCA normal rend peu probable un niveau élevé d’anticoagulation et permet une prise en charge standard. Un TCA prolongé peut témoigner de la présence de l’anticoagulant, mais ne renseigne ni sur sa concentration exacte, ni sur le degré d’anticoagulation. Par ailleurs, un TCA allongé peut résulter d’autres causes que la présence d’un anti-XI(a) (coagulopathie de consommation liée au saignement, anticoagulant lupique, etc.).
Concernant la réversion, les mêmes options que pour les procédures invasives sont proposées :
• pour les petites molécules et les mAb : rFVIIa ;
• pour les ASO : l’administration de faibles doses de concentrés de FXI permet une réversion partielle de l’effet anticoagulant mais peut exposer à un risque thrombotique, en particulier chez les patients présentant des facteurs de risque cardiovasculaire. Le dosage du FXI
plasmatique peut être envisagé après administration, surtout en cas de saignement persistant ou récidivant. Le rFVIIa est l’alternative aux concentrés de FXI.
Le moment de la réversion varie selon la sévérité du saignement : pour les hémorragies mettant en jeu le pronostic vital ou fonctionnel et ne pouvant être rapidement contrôlées par les mesures standards, ou en cas de choc hémorragique, un traitement urgent est nécessaire. Pour les autres hémorragies sévères, la réversion doit être discutée en cas de saignement persistant malgré les gestes hémostatiques ou lorsque de tels gestes ne sont pas réalisables.
La question d’une thromboprophylaxie veineuse pharmacologique après une procédure invasive ou un épisode hémorragique reste non résolue. Une héparine de bas poids moléculaire (HBPM) peut être envisagée, en particulier si les petites molécules comme milvexian ou asundexian sont interrompues et que rFVIIa ou des concentrés de FXI ont été utilisés.
Reprise du traitement anti-FXI(a)
La reprise du traitement anti-FXI(a) après chirurgie ou hémorragie sévère est peu documentée.
Pour les petites molécules, la stratégie thérapeutique en FA ou MTEV est similaire à celle des AOD : après une procédure à haut risque hémorragique, l’anticoagulation curative est en général reprise dans les 48 à 72 heures. Après un épisode hémorragique sévère, les mêmes délais sont habituellement proposés, une fois le contrôle hémostatique obtenu. Après une hémorragie intracérébrale, la conduite à tenir n’est pas tranchée. Pour la MTEV, une HBPM peut être utilisée en prophylaxie jusqu’à la reprise d’un traitement anti-FXI(a).
Avec les anti-FXI(a) à longue durée d’action (oligonucléotides antisens, mAb), les patients restent anticoagulés par le médicament, quelle que soit la stratégie adoptée.
CONCLUSION
Les options présentées ci-dessus ne constituent que des propositions, fondées sur un niveau de preuve faible. Elles visent à aider les cliniciens confrontés à ces molécules dans des situations qui n’ont pas encore été évaluées de manière rigoureuse. Elles ont également pour objectif de mettre en évidence les « zones d’ombre » de la prise en charge de ces patients et les besoins de recherche associés. Ces propositions seront réévaluées au fur et à mesure de la publication de nouvelles données. Enfin, la mise en place d’un registre dédié à la prise en charge des anti-FXI(a) en contexte de procédures invasives ou de complications hémorragiques apparaît nécessaire.
POINTS CLÉS À RETENIR
• La prise en charge des hémorragies et des procédures invasives chez les patients traités par un anti-facteur XI(a) ne dispose pas encore de protocoles pratiques clairement établis.
• Les données disponibles suggèrent que les anti-FXI(a) sont associés à un faible risque hémorragique, mais les modalités de leur réversion soulèvent des questions.
• Dans une démarche de gestion du risque, des experts proposent des recommandations fondées sur les données d’essais cliniques et l’expérience du déficit en FXI.
• Ces options aident les cliniciens confrontés à ces anticoagulants dans des situations encore peu étudiées et mettent en lumière les principaux besoins de recherche.
Liens d’intérêts : cet article est une traduction de l’article original publié dans Research and Practice in Thrombosis and Haemostasis (RPTH) : Res Pract Thromb Haemost. 2025 ; 9 (3) : 102860. doi :10.1016/j. rpth.2025.102860. Anne GODIER déclare avoir des liens d’intérêts avec Aguettant, Alexion, Bayer Healthcare, BMS-Pfizer, Boehringer Ingelheim, Sanofi, CSL Behring, LFB, Octapharma, Stago et Viatris ; Anne-Céline MARTIN déclare avoir des liens d’intérêts avec Abbott, Bayer Healthcare, BMS-Pfizer, Boehringer Ingelheim et Novartis ; Gilles PERNOD déclare avoir des liens d’intérêts avec Bayer Healthcare,
BMS-Pfizer et Anthos Therapeutics ; Pierre ALBALADEJO déclare avoir des liens d’intérêts avec Bayer Healthcare, BMS-Pfizer et Sanofi ; Pierre FONTANA déclare avoir des liens d’intérêts avec Novo Nordisk et Sobi ; Mikael MAZIGHI déclare avoir des liens d’intérêts avec Boehringer, Novartis, Novo Nordisk, Acticor et AstraZeneca ; Jerrold H. LEVY déclare avoir des liens d’intérêts avec Merck, Octapharma, Takeda et Werfen ; Grégoire LE GAL déclare avoir des liens d’intérêts avec Aspen Pharma, BMS, Leo Pharma, Pfizer, Sanofi et Stago ; François MULLIER déclare avoir des liens d’intérêts avec Fresenius, Technoclone, Stago et Werfen ; Stéphanie ROULLET déclare avoir des liens d’intérêts avec Bayer Healthcare, BMS-Pfizer, CSL Behring, LFB, MSD et Sanofi ; Isabelle GOUIN-THIBAULT déclare avoir des liens d’intérêts avec BMS-Pfizer, Leo Pharma, Sanofi, Stago et Viatris ; Sophie SUSEN déclare avoir des liens d’intérêts avec CorWave, Pfizer, Roche-Chugai, Stago, Biomarin, Bioverativ, CSL Behring, LFB, Novo Nordisk, Sanofi, Shire/Takeda, Siemens Healthiners, Stago et Sobi. Les autres auteurs déclarent ne pas avoir de lien d’intérêt en rapport avec cet article.

