RÉSUMÉ
Les anticoagulants ciblant le facteur XI (FXI), activé (a) ou non, actuellement en développement comprennent des oligonucléotides antisens, des anticorps monoclonaux et de petites molécules de synthèse. De même que les anticoagulants oraux directs (AOD) ciblant la thrombine ou le facteur Xa, ils sont développés sans ajustement posologique fondé sur le résultat d'un test de laboratoire. Cependant, il est essentiel de connaître leur impact sur les tests de coagulation, afin d'éviter une interprétation erronée des bilans d'hémostase, mais aussi dans l'objectif de disposer d'un test permettant d'estimer le niveau d'anticoagulation en cas de situation urgente. Un allongement du TCA a été documenté avec tous les anticoagulants ciblant le FXI(a), mais celui-ci varie selon les réactifs et la molécule, et l’absence de données précises rend l’interprétation de ce test difficile. Le niveau de FXI mesuré par méthode chronométrique (FXI:C) n'est diminué qu’en cas de traitement par oligonucléotides antisens. Lors de traitements par un anticorps monoclonal ou une petite molécule, la mesure du FXI:C et des autres facteurs de la voie intrinsèque, si nécessaire, doit être réalisée après plusieurs dilutions du plasma afin de lever l'interférence de l’anticoagulant sur le TCA. Les autres tests utilisés dans les essais cliniques pour évaluer l'effet anticoagulant de ces traitements (mesure du FXIa, test de génération de thrombine) ne sont habituellement pas effectués dans les laboratoires de biologie médicale. Des données plus précises concernant l'interférence analytique des anticoagulants ciblant le FXI(a) sur les tests de coagulation sont nécessaires pour anticiper leur utilisation après leur mise sur le marché.MOTS CLÉS
activité anti-XIa, anticoagulants anti-XI/XIa, TCA, tests d’hémostase
ABSTRACT
Anticoagulant drugs targeting FXI(a) under development include antisense oligonucleotides, monoclonal antibodies and small molecules. They do not require routine monitoring, but understanding their impact on coagulation tests is essential – both to avoid misinterpretation of haemostasis assessments and to estimate the level of anticoagulation in emergency situations. A concentration-dependent prolongation of activated partial thromboplastin time has been shown but varies according to reagents and drugs, and the lack of comprehensive data makes this test difficult to interpret. The FXI level measured by a clotting assay (FXI:C) is decreased only in the case of treatment with antisense oligonucleotides. During treatment with monoclonal antibodies or small synthetic molecules, measurement of FXI:C and other intrinsic pathway factors, if necessary, should be performed after several plasma dilutions in order to overcome the interference of the anticoagulant on the aPTT. Other tests used in clinical trials to assess the anticoagulant effect (measurement of FXIa, thrombin generation assay) are not available in clinical laboratories. More comprehensive information on the effect of anticoagulants targeting FXI(a) on haemostasis tests is urgently needed to anticipate the use of these drugs once they are approved.
KEYWORDS
activity anti-XIa, anti-XI/XIa anticoagulants, aPTT, haemostasis tests
INTRODUCTION
L’inhibition de la voie intrinsèque (voie de la phase contact) de la coagulation au niveau du facteur XI (FXI) représente une approche considérée comme prometteuse pour le traitement et la prévention de la thrombose, tout en minimisant le risque hémorragique. Plusieurs stratégies ont été proposées pour inhiber le FXI et/ou le FXI activé (FXIa), avec trois médicaments actuellement en développement clinique de phase III (1,2). Ces molécules diffèrent en termes de mécanismes d’action et de caractéristiques pharmacologiques, avec un potentiel retentissement sur la prise en charge des patients traités en situation d’urgence.
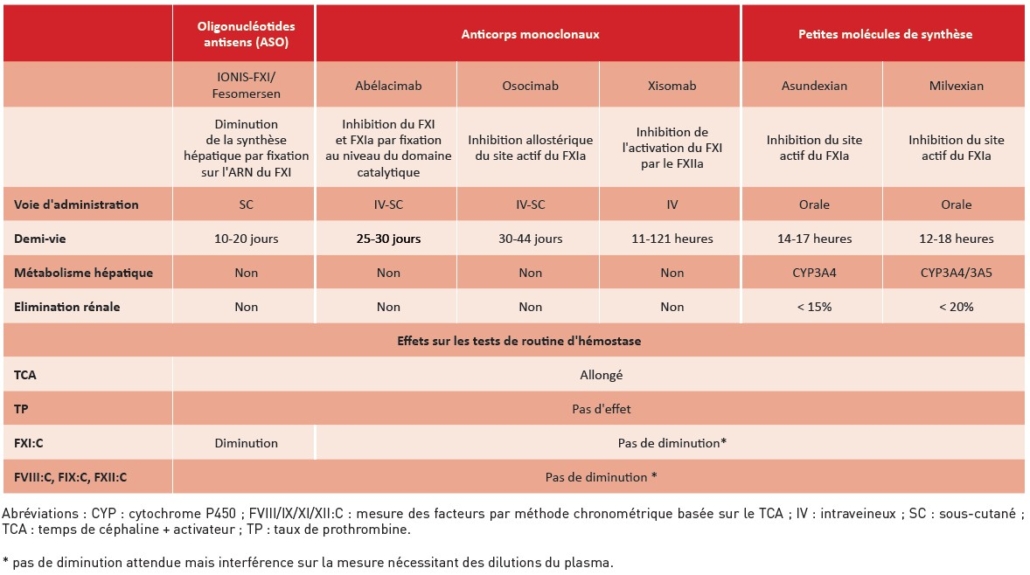
• Les oligonucléotides antisens (Ionis-FXI, Ionis-FXI-Lrx) inhibent la synthèse du FXI en se fixant sur les séquences d’ARNm de façon spécifique et réversible, empêchant ainsi leur traduction. Le fesomersen (Ionis-FXI-Lrx) est une forme modifiée du Ionis-FXI permettant par conjugaison à la N-acétylgalactosamine, d’optimiser sa captation et sa concentration hépatocytaire, et ainsi de réduire la fréquence d’administration par voie sous-cutanée (SC), de (bi)-hebdomadaire pour le Ionis-FXI à mensuelle pour le Ionis-FXI-Lrx. Le délai avant obtention de l’effet maximum, soit une réduction allant jusqu’à 75 % de la concentration initiale du FXI est long jusqu’à plusieurs semaines, de même l’effet anticoagulant est ensuite maintenu pendant plusieurs semaines. Il n’y a ni métabolisation hépatique, ni élimination rénale, ce qui limite le risque d’interactions médicamenteuses.
• Les anticorps monoclonaux (abélacimab, osocimab, xisomab) diffèrent par leur mécanisme d’action mais ont en commun une administration mensuelle par voie parentérale, un délai d’action rapide (quelques heures), une demi-vie longue (plusieurs jours à plusieurs semaines), un métabolisme n’impliquant pas les cytochromes P450 (CYP) hépatiques, ce qui limite le risque d’interactions médicamenteuses et une élimination non dépendante du rein puisque ces molécules sont éliminées par le système des phagocytes mononucléés. Leur liaison avec le FXI(a) est réversible et hautement spécifique. Comme pour tous les anticorps thérapeutiques, il existe un risque non encore observé d’apparition d’anticorps neutralisants anti-médicaments (antidrug antibody ou ADA). L’abélacimab est un anticorps humanisé administré par voie SC ou intraveineuse (IV). Il se fixe au niveau du domaine catalytique (qui contient le site actif) du FXI ou FXIa, induisant un changement de conformation et bloquant le FXI/FXIa dans un état inactif dit « zymogen-like ». Son délai d’action est rapide, avec un effet maximal pouvant aller jusqu’à quelques jours (lorsqu’il est administré par voie SC), et sa demi-vie est de 20 à 28 jours. L’osocimab est également un anticorps humanisé, administré par voie IV et SC. Il se fixe sur une région proche du site actif du FXIa, entraînant un réarrangement bloquant son activité. Sa demi-vie est de 30 à 44 jours. Le xisomab, administré par voie IV, se fixe sur le domaine « apple domain 2 » et empêche l’activation du FXI par le FXIIa ; l’activation du FXI par la thrombine est conservée. Sa demi-vie varie de 11 à 121 h en fonction de la posologie.
• Les petites molécules de synthèse (asundexian, milvexian) sont des inhibiteurs directs, spécifiques et réversibles du FXIa, actifs par voie orale. Leur délai d’action est rapide, de l’ordre de 2 à 4 h et leur demi-vie est de 12 à 16 h. Elles sont métabolisées par les CYP3A4 (asundexian, milvexian) et CYP3A5 (milvexian), ce qui constitue une cause potentielle d’interférences médicamenteuses. Leur élimination rénale sous forme active est limitée (< 20 %).
Plusieurs essais cliniques de phases II et III visant à évaluer l’efficacité et la sécurité de ces nouveaux anti- coagulants dans divers contextes sont en cours (2). À l’instar des anticoagulants oraux directs (AOD) anti-FXa ou anti-FIIa, utilisés depuis plus d’une décennie, les anticoagulants ciblant le FXI(a) ont été développés pour être administrés à dose fixe, sans ajustement posologique basé sur des tests de laboratoire, ce qui constitue une avancée indéniable par rapport aux antagonistes de la vitamine K. Cependant, bien que la surveillance biologique ne soit pas systématiquement requise, il est utile de connaître l’impact de ces anti-coagulants sur les tests d’hémostase, en particulier pour la prise en charge des patients dans les situations d’urgence, telles que les hémorragies graves/non contrôlées ou les interventions invasives urgentes. Il est également utile de connaître l’interférence analytique de ces anticoagulants sur les tests d’hémostase réalisés dans le cadre de l’évaluation clinique des patients, au-delà de la simple appréciation de leur effet anticoagulant (par exemple, dans un contexte de recherche d’anticoagulant circulant de type lupique, ou de tests dépendant du temps de céphaline avec activateur (TCA) en particulier le bilan pré-opératoire, etc.).
Malheureusement, dans les études cliniques qui ont évalué l’efficacité et la sécurité des anticoagulants ciblant le FXI(a), les données pharmacodynamiques et leur interprétation sont limitées, peu détaillées et parfois sujettes à des erreurs d’interprétation. Par conséquent, les données actuellement disponibles sont insuffisantes et peuvent prêter à confusion, conduisant ainsi potentiellement à une prise en charge clinique inadaptée des patients.
RETENTISSEMENT SUR LES TESTS D’HÉMOSTASE : TP ET TCA
Les données pharmacodynamiques concernant les anti-coagulants ciblant le FXI et/ou FXIa en cours de développement ont montré, sans surprise, un allongement du TCA (temps de céphaline avec activateur) alors que le temps de Quick (ou taux de prothrombine) reste inchangé. L’allongement du TCA est dose/concentration-dépendant pour les anticorps monoclonaux et les petites molécules de synthèse (1). Cependant, l’effet sur le TCA varie selon la molécule et le réactif utilisé avec des seuils de sensibilité aux faibles concentrations non définis (3,4). En effet, la variabilité de l’allongement du TCA en présence d’anticoagulants ciblant le FXI/FXIa est attendue, par analogie à ce qui est décrit lors d’un déficit constitutionnel en FXI, avec une sensibilité variable aux déficits modérés en FXI (> 20 %), et un allongement systématique du TCA en cas de déficits plus profonds. Cela est lié d’une part aux différents types de réactifs (nature de l’activateur de la phase contact –kaolin, célite, silice ou acide ellagique – et composition/concentration en phospholipides), et d’autre part à des facteurs liés au patient, avec par exemple une diminution de la sensibilité du TCA en cas de syndrome inflammatoire suite à une augmentation de la concentration en FVIII. Les réactifs utilisés pour le TCA ne sont pas toujours précisés dans les études in vitro ou cliniques (ex vivo) publiées, et ceux mentionnés diffèrent d’une étude à l’autre (2,4,5). De plus, dans la plupart des études, les résultats du TCA sont exprimés en pourcentage de variation par rapport à la valeur de base ou en ratio par rapport à la valeur initiale du patient avant administration du médicament, plutôt qu’en ratio par rapport à un temps de coagulation témoin, ce qui rend leur extrapolation difficile en pratique (6-8).
Enfin, l’utilisation du TCA chez les patients traités par anticoagulants ciblant le FXI et/ou FXIa pour évaluer le niveau d’anticoagulation, peut être limitée par le fait qu’un allongement du TCA n’est pas toujours associé à un risque hémorragique, mais peut résulter d’un déficit en une protéine de la phase contact (FXII, prékallicréine ou kininogène de haut poids moléculaire), de la présence d’un anticoagulant circulant de type lupique, ou encore pour certains réactifs d’une concentration élevée en protéine C-réactive (CRP).
RETENTISSEMENT SUR LA MESURE DU FXI PAR MÉTHODE CHRONOMÉTRIQUE (FXI:C) ET MESURE DE L’EFFET INHIBITEUR SUR LE FXIa
Au-delà de l’effet sur le TCA, une diminution de la concentration plasmatique du FXI est attendue avec les oligo-nucléotides antisens, qui réduisent la biosynthèse du FXI jusqu’à 75 % après 6 semaines de traitement avec une normalisation de la concentration environ 3 mois après l’arrêt du traitement (4). En revanche, les médicaments qui empêchent l’activation du zymogène ou inhibent la forme activée du FXI ne devraient pas modifier la concentration plasmatique du FXI.
Il est en effet important de bien distinguer une véritable diminution de la quantité de FXI circulant (antigénique), d’une inhibition de son activation ou de son activité.
La concentration en FXI, comme celle des autres facteurs de coagulation, exprimée en UI/dL ou en pourcentage, est le plus souvent déterminée par la mesure de son activité coagulante (FXI:C) dans un mélange à volumes égaux de plasma patient dilué et de plasma réactif déficient en FXI, selon un test basé sur le TCA.
Comme pour tout inhibiteur présent dans le plasma du patient – anticoagulant circulant de type lupique, auto-anticorps dirigés contre un facteur de coagulation, ou médicaments anticoagulants – une interférence avec le TCA peut entraîner un allongement du temps de coagulation en l’absence de véritable déficit en facteur. Il est donc recommandé de mesurer les facteurs de coagulation en effectuant plusieurs dilutions successives du plasma du patient, afin de neutraliser complètement ou partiellement l’effet inhibiteur. Cet effet inhibiteur a déjà été rapporté chez des patients traités par AOD – anti-FXa ou anti-FIIa – lors de la mesure des facteurs par des méthodes chronométriques.
Si ces mesures ne sont pas réalisées avec des dilutions croissantes, il peut être conclu à tort à un déficit en facteur de coagulation.
Dans une étude monocentrique in vitro récente, il a été montré que l’interférence de l’asundexian et du milvexian sur la mesure de TCA, FVIII:C, FIX:C, FXI:C pouvait être levée après un pré-traitement du plasma par le charbon activé (3).
La plupart des essais cliniques de phase I ou II portant sur des anticoagulants ciblant le FXI(a), ainsi qu’une étude in vitro, ont rapporté une diminution dose- ou concentration-dépendante du FXI:C alors qu’il ne s’agit pas d’un authentique déficit en FXI, comme expliqué
précédemment (3-6,9). Cependant, les conditions de dilution du plasma n’étaient pas précisées. De plus, les mesures des FVIII, FIX et FXII par des méthodes basées sur le TCA n’étaient pas rapportées dans les études cliniques, bien qu’elles soient très probablement également affectées par la présence de l’anti-FXI(a) (5,6,9,10). En effet, une étude in vitro avec l’asundexian et le milvexian montre une diminution concentration-dépendante des FVIII:C, FIX:C et FXII:C, sans précision sur le niveau de dilution (3).
Ainsi, une mauvaise interprétation du niveau de FXI:C – en concluant par exemple à la présence d’un déficit en FXI:C ou en estimant faussement l’effet anticoagulant de l’anti-FXI/FXIa selon le taux mesuré du FXI:C – pourrait conduire à une prise en charge inappropriée des patients en situation d’urgence. En revanche, la mesure du niveau plasmatique du FXI:C avant le début du traitement pourrait être utile pour interpréter correctement d’éventuels tests ultérieurs, pendant le traitement.
Au total, la mesure du FXI:C aurait potentiellement un intérêt pour la prise en charge des patients en situation d’urgence, uniquement chez ceux traités par des oligonucléotides antisens, selon les mêmes modalités et avec les mêmes limites qu’en cas de déficit constitutionnel en FXI.
La mesure de la concentration antigénique du FXI par ELISA – exceptionnellement utilisée dans des laboratoires spécialisés de biologie médicale – ainsi que la mesure de l’activité inhibitrice anti-FXIa, ont été réalisées pour l’asundexian. Les concentrations antigéniques du FXI n’étaient pas modifiées, tandis que les valeurs du FXI:C diminuaient avec l’augmentation de la concentration du médicament, confirmant ainsi l’absence de déficit en FXI induit par cet anticoagulant et la présence d’une interférence attendue avec la mesure du FXI:C (5).
Une méthode destinée à mesurer l’effet inhibiteur de l’asundexian sur l’activité de FXIa humain ajouté a été développée par Bayer. Cette méthode repose sur un test fluorimétrique détectant la libération d’aminométhyl-coumarine (AMC) à partir d’un substrat peptidique
synthétique clivé par le FXIa (1). En pratique, sont ajoutés, à des plasmas normaux surchargés avec différentes concentrations d’asundexian (utilisées pour établir la courbe d’étalonnage) ou à un échantillon plasmatique contenant de l’asundexian (pour mesurer sa concentration), du FXIa humain (Kordia®) et un substrat de FXIa (Boc-Glu(OBzl)-Ala-Arg-aminométhylcoumarine [AMC], Bachem® I-1575). L’ensemble est distribué dans les puits d’une plaque de microtitration, et la fluorescence est mesurée durant 30 minutes à température ambiante. Cette méthode a été modifiée dans certains essais cliniques par l’ajout de kaolin afin d’activer la coagulation et de générer du FXIa endogène, sans que des précisions méthodologiques soient disponibles. Il s’agit d’une méthode propriétaire qui n’est pas utilisée en routine dans les laboratoires de biologie médicale.
Des kits commercialisés par Rossix et Hyphen Biomed ont été développés pour la mesure du FXIa (c’est-à-dire de la forme déjà activée) dans les concentrés de FXI humains, en utilisant une méthode chromogénique. Cependant, une telle approche ne doit pas être confondue avec un test visant à détecter une inhibition du FXIa, et ne semble d’aucune utilité en tant que telle, pour évaluer l’effet des anti-coagulants ciblant le FXI et/ou FXIa.
EFFETS SUR LES AUTRES TESTS (1)
Compte tenu de leur mécanisme d’action, il est attendu que les anticoagulants ciblant le FXI(a) impactent les tests de coagulation basés sur le TCA.
Dans une étude in vitro, il n’a pas été rapporté d’effet de l’asundexian et du milvexian sur la mesure du fibrinogène (von Clauss, Dade Thrombin®), de l’antithrombine (Berichrom Antithrombin assay®), de l’activité chromogénique de la protéine C (snake venom-based Berichrom Protein C assay®), de la protéine S libre antigénique (INNOVANCE Free Protein S assay®), du Willebrand antigène (immunoturbidimetric VWF:Ag Assay®) et activité (BC von Willebrand assay®) et de la recherche d’anticoagulant circulant de type lupique (dRVVT ; LA Screen, LA Confirm®) (3). En revanche, une interférence sur la mesure de la protéine C activée réalisée avec ProC Global® assay (Siemens Healthcare Diagnostics), a été mise en évidence et peut être levée par un pré-traitement du plasma avec du charbon activé (3).
Chez les patients avec un déficit marqué en FXI, le test de génération de thrombine (TGT) permet d’identifier ceux exposés à un risque hémorragique lors d’une chirurgie.
Le TGT a été utilisé lors du développement de certains anticoagulants ciblant le FXI(a). Cependant, sa réalisation nécessite la mise en œuvre de conditions expérimentales particulières et adaptées (présence d’un inhibiteur du FXIIa – CTI pour corn trypsin inhibitor) dans le tube de
prélèvement, plasma riche en plaquettes, très faible concentration de facteur tissulaire). Le TGT n’est pas réalisable en urgence, ni d’utilisation répandue. Il a été utilisé pour sélectionner les meilleurs candidats thérapeutiques pour neutraliser l’effet des anticoagulants ciblant le FXI(a), en cas d’hémorragie ou avant un geste à risque hémorragique, mais les conditions expérimentales requises ne sont pas toujours respectées.
Les données sur l’effet de ces anticoagulants évalué avec les tests viscoélastométriques ou apparentés (TEG®, ROTEM®, Quantra®) sont encore très limitées.
Une étude multicentrique nationale en cours sous l’égide du groupe TITANS de la Société Française de Thrombose et Hémostase (SFTH), permettra de disposer de données plus complètes sur l’impact des anticoagulants ciblant le FXI(a) sur des tests d’hémostase de routine et spécialisée réalisés avec différents réactifs et automates.
En conclusion, les médicaments anticoagulants ciblant le FXI(a) ont des mécanismes d’action distincts et des effets variés sur les tests de coagulation. Il est essentiel de prêter une attention particulière aux méthodes et aux conditions expérimentales utilisées dans les études
cliniques afin d’éviter toute interprétation erronée.
Ces médicaments anticoagulants ne nécessitent aucune surveillance biologique systématique mais l’absence de test validé pour évaluer leur effet anticoagulant complique la prise en charge en situation urgente des patients traités. Le TCA est allongé de façon dose/concentration-dépendante et variable en fonction des molécules et des réactifs mais il manque de spécificité. La mesure du FXI:C aurait potentiellement un intérêt en cas de situations urgentes, uniquement chez les patients traités par des oligonucléotides antisens, selon les mêmes modalités et avec les mêmes limites qu’en cas de déficit constitutionnel en FXI. Pour les autres molécules ciblant le FXI(a), la mesure de la concentration en FXI:C serait d’un apport limité voire nul pour la prise en charge des patients.
Une collaboration entre les sociétés professionnelles et l’industrie pharmaceutique est indispensable pour approfondir les connaissances sur les effets des anticoagulants ciblant le FXI(a) sur les tests de coagulation.
POINTS CLÉS À RETENIR
• Les anticoagulants ciblant le FXI(a) actuellement en développement comprennent des oligonucléotides antisens, des anticorps monoclonaux et de petites molécules de synthèse.
• Leurs propriétés pharmacologiques différent avec un impact potentiel sur la prise en charge des patients en situation d’urgence.
• Le TCA est allongé avec tous les anticoagulants ciblant le FXI(a), de façon dose-dépendante (sauf avec les oligonucléotides antisens) et variable en fonction des molécules et des réactifs.
• La mesure du FXI:C aurait potentiellement un intérêt uniquement chez les patients traités par des oligonucléotides antisens.
• Il n’existe pas aujourd’hui de test commercialisé permettant de mesurer l’activité anti-XIa de ces molécules.
ANNEXE
Tableau 1 : Principales caractéristiques des anticoagulants ciblant le facteur XI(a) en développement et effets sur les tests de routine d’hémostase.
Table 1: Main characteristics of anticoagulants targeting factor XI(a) in development and effect on routine hemostasis tests.