RÉSUMÉ
L’efanesoctocog alfa est un nouveau facteur VIII recombinant pour la prophylaxie et le traitement de l’hémophilie A, disponible en France depuis octobre 2025. Sa structure modifiée lui confère une demi-vie prolongée, permettant une injection hebdomadaire efficace pour maintenir une activité hémostatique élevée et durable. Le dosage biologique de l’efanesoctocog alfa nécessite une adaptation des méthodes classiques, car les résultats varient selon les réactifs utilisés. La calibration spécifique des dosages chronométriques et chromogéniques pourrait être la solution pour garantir la précision des résultats de mesure d’activité, notamment en cas de chirurgie ou lors de changement de traitement. La commercialisation d’un calibrant spécifique efanesoctocog alfa et des contrôles de qualité est annoncée dans les prochains mois. L’évolution des pratiques de laboratoire en adaptant les outils biologiques disponibles sera essentielle, tant pour la mesure d’activité que pour la détection des inhibiteurs, afin d’accompagner cette innovation thérapeutique dont tous les effets en vie réelle restent encore à évaluer.MOTS CLÉS
dosage, efanesoctocog alfa, facteur VIII, hémophilie A
ABSTRACT
Efanesoctocog alfa is a new recombinant factor VIII for the prophylaxis and treatment of hemophilia A, available in France since October 2025. Its modified structure gives it a prolonged half-life, allowing for effective weekly injections to maintain high and sustained hemostatic activity. The biological assay of efanesoctocog alfa requires adaptation of conventional methods, as results vary depending on the reagents used. Specific calibration of chronometric and chromogenic assays could be the solution to ensure the accuracy of activity measurements, particularly in cases of surgery or treatment changes. A specific efanesoctocog alfa calibrator and quality controls is announced available in the coming months. The evolution of laboratory practices by adapting the available biological tools will be essential, both for activity measurement and inhibitor detection, to support this therapeutic innovation, the real-life effects of which have yet to be evaluated.
KEYWORDS
assay, efanesoctocog alfa, factor VIII, hemophilia A
INTRODUCTION
La mise sur le marché français en octobre 2025 de l’efanesoctocog alfa permet d’ajouter une nouvelle molécule dans l’arsenal de thérapie substitutive de l’hémophilie A. De par sa structure largement modifiée mais également ses propriétés pharmacocinétiques, l’efanesoctocog alfa est un facteur VIII recombinant différent, permettant ainsi de définir une nouvelle catégorie de FVIII thérapeutique : les Ultra long modified FVIII. Ce terme a été proposé pour différencier cette nouvelle molécule des FVIII à demi-vie prolongée ou FVIII-EHL pour FVIII Extended Half life (1). La surveillance biologique de l’efanesoctocog alfa doit elle aussi être adaptée puisque les données de la littérature font état de discordances entre les méthodes de dosage chronométrique et chromogénique de l’activité du FVIII (FVIIII:C) mais également entre les différents réactifs disponibles. L’indication de la mesure d’activité de l’efanesoctocog alfa lors du traitement prophylactique reste encore à préciser. En effet, selon l’autorisation de mise sur le marché (AMM), aucune adaptation posologique
n’est indiquée lors de la prophylaxie, une dose unique de 50 UI/kg est préconisée assurant une correction de l’hémostase dont l’amplitude et la durée restent inégalées par les autres options thérapeutiques substitutives actuellement disponibles. La mesure d’activité de l’efanesoctocog alfa sera néanmoins nécessaire dans les contextes chirurgicaux et le biologiste médical doit s’assurer de la disponibilité d’une mesure d’activité précise, fiable et répétable.
UN NOUVEAU FVIII THÉRAPEUTIQUE DE CONCEPTION UNIQUE
Jusqu’à présent les stratégies utilisées pour prolonger la demi-vie des molécules de rFVIII ont été basées sur le développement soit d’un rFVIII complexé au polyéthylène glycol (PEGylation) dont l’élimination est retardée, soit d’un rFVIII fusionné au fragment Fc des immunoglobulines IgG1, retardant la dégradation du rFVIII par recyclage de ce dernier dans les cellules porteuses du récepteur pour les IgG, FcRn. Ces modifications structurales n’ont eu qu’un impact modéré sur la demi-vie du rFVIII, augmentée d’environ 1,5 à 1,8 fois, contrairement aux molécules de facteur IX recombinant EHL, pour qui la même approche a permis de majorer de 4 à 5 fois la demi-vie du FIX par rapport à un facteur IX standard (2). La principale raison expliquant cette augmentation limitée de la demi-vie des rFVIII EHL est liée au facteur von Willebrand (VWF) endogène. Ainsi, la demi-vie d’élimination du VWF (environ 15-19 heures) est donc le facteur limitant essentiel à une prolongation de la durée de vie en circulation du FVIII (3). Le développement de l’efanesoctocog alfa a donc été fondé sur une triple stratégie (4) afin de :
• Concevoir une molécule recombinante de FVIII capable de ne pas interagir avec le VWF endogène du patient traité en fusionnant un rFVIIIBDD au domaine D’D3 du VWF. Ce fragment D’D3 permet à la clairance de l’efanesoctocog alfa d’être indépendante de celle du VWF endogène, et préserve la fonction stabilisatrice du VWF vis-à-vis du FVIII puisqu’il contient son site de liaison spécifique à cette protéine ;
• Diminuer la clairance et la dégradation du rFVIII grâce à la fusion du FVIII avec un fragment Fc IgG1 et à l’ajout de deux séquences polypeptidiques hydrophiles (XTEN) : l’une de 288 acides aminés située entre les domaines A2 et A3 du FVIII, et l’autre de 144 acides aminés située entre les domaines D’D3 et Fc. De plus, la région acide a2 du FVIII, site de clivage par la thrombine, a été insérée entre les domaines D’D3 et Fc. Ce site permet au rFVIII d’être libéré des domaines D’D3 dès que les premières traces de thrombine sont générées après l’activation de la coagulation.
L’efanesoctocog alfa est produit dans des cellules HEK293 après transfection avec trois vecteurs d’expression (5) : l’un codant pour le rFVIIIBDD fusionné au fragment Fc, un second codant pour les domaines D’D3 et D1D2 du VWF et un troisième plasmide PACE/Furin qui permettra de cliver le domaine D1D2 (Figure 1). Cette nouvelle structure moléculaire permet d’envisager de nouvelles caractéristiques pharmacocinétiques
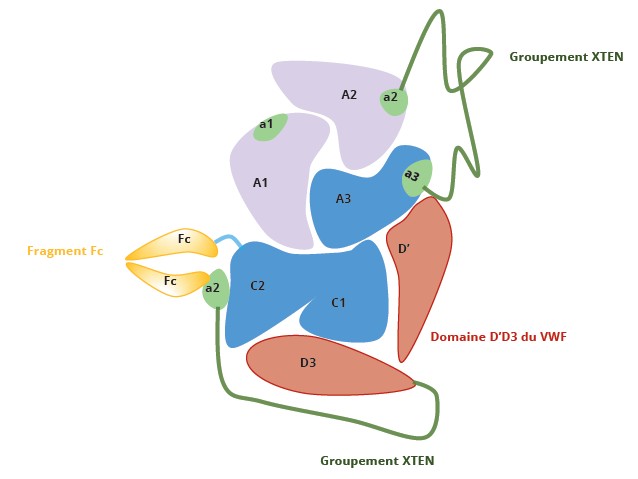
Figure 1 : Structure schématique de l’efanesoctocog alfa. Adaptée de (4,6).
Figure 1: Schematic structure of efanesoctocog alfa. Adapted from (4,6).
Légende : traits verts : les groupements XTEN, chaînes polypeptidiques ; en rouge : le domaine D’D3 du VWF ; en violet et bleu : structure d’un FVIII recombinant délété du domaine B, sous forme hétérodimérique (chaîne lourde composée des domaines A1 et A2 et chaîne légère composée des domaines A3, C1 et C2 ; a1, a2, a3 représentent les régions acides du facteur VIII site de clivage de la thrombine lors de l’activation ; en jaune : fragment Fc d’une immunoglobuline IgG1.
DES NOUVELLES CARACTÉRISTIQUES PHARMACOCINÉTIQUES (7)
L’efanesoctocog alfa présente une demi-vie allongée par rapport au rFVIII EHL. Dans les différentes études cliniques, elle est estimée à 47 h (42,3 à 52,2 h) chez les patients adultes. Chez des patients adultes traités en prophylaxie par une injection hebdomadaire, le taux d’efanesoctocog alfa est maintenu supérieur à 40 % pendant 3 à 4 jours et supérieur à 10-12 % pendant 7 jours (7).
SURVEILLANCE BIOLOGIQUE DE L’EFANESOCTOCOG ALFA
Les études cliniques montrent une faible variabilité des paramètres pharmacocinétiques entre les individus traités à la posologie de 50 UI/kg/semaine. La faible variation des taux résiduels obtenus à J+7 permet de prétendre à une couverture hémostatique suffisante chez les patients traités sans nécessité de dosage biologique pour adapter le traitement (7). Néanmoins, les études en vie réelle, dans une population moins sélectionnée, permettront d’évaluer la variabilité individuelle à plus grande échelle. Elles évalueront également la pertinence du dosage biologique pour l’adaptation posologique.
COMMENT DOSER L’EFANESOCTOCOG ALFA : LES RÉSULTATS D’ÉTUDES IN VITRO
Alors que la pharmacopée européenne recommande l’utilisation du dosage chromogénique pour déterminer le titre des concentrés en FVIII, l’efanesoctocog alfa est le premier concentré dont le titre est mesuré en utilisant la méthode chronométrique. Le réactif utilisé est l’Actin FSL (8). Plusieurs études dans la littérature font état de discordances entre les dosages chromogéniques et chronométriques mais également entre les réactifs utilisés (Tableau 1). Il s’agit principalement d’études in vitro, peu de données en vie réelle sont actuellement disponibles.
La première étude multicentrique en 2023 a fait participer 35 laboratoires dont 13 laboratoires français (8). Chaque laboratoire recevait 2 séries de plasmas déficients en FVIII surchargés soit en octocog alfa soit en efanesoctocog alfa à 5 %, 20 % et 80 %. Les activités de FVIII étaient mesurées par chaque laboratoire, en aveugle, avec leur couple réactif/automate usuel en technique chronométrique et/ou technique chromogénique. Une différence de +/- 20 % par rapport aux taux cibles était jugée comme acceptable.
Les résultats obtenus par la technique chronométrique, tous réactifs confondus, montraient des valeurs par rapport aux taux cibles (80 %, 20 % et 5 %) de 116 %, 133 % et 160 % pour l’efanesoctocog alfa et de 84 %, 91 % et 104 % pour l’octocog alfa. L’analyse plus détaillée des résultats montrait qu’il existait des résultats hétérogènes en fonction des réactifs utilisés. Ces différences étaient indépendantes du type d’automate utilisé et semblaient dépendre de la composition en phospholipides utilisés dans les réactifs plus que du type d’activateur (silice, acide ellagique, ou kaolin).
En fonction des réactifs utilisés, il était observé (Tableau 1) :
• Une sous-estimation des taux d’efanesoctocog alfa avec certains réactifs : le réactif SynthasIL sous-estimait de 30 à 40 % l’activité de l’efanesoctocog pour les taux de 80 % et 20 % ; alors qu’il n’existait pas de différence significative par rapport à un taux cible de 5 %. Des résultats comparables étaient obtenus avec le réactif APTT SP ;
• Une surestimation des taux d’efanesoctocog alfa : le réactif Actin FS surestimait de l’ordre de 225 %, 253 % et 285 % respectivement, les plasmas contenant la molécule à des taux attendus de 80 %, 20 % et 5 %. Des résultats comparables ont été obtenus avec les réactifs Cephen, Actin et Cephascreen ;
• Des résultats conformes uniquement sur la gamme de mesure 80-20 % pour certains réactifs : Synthafax, PTT-A, aPTT-HS, Pathromtin SL et CK-Prest. Une surestimation a été observée pour le taux d’efanesoctocog alfa à 5 % avec ces réactifs.
Tableau 1 : Acceptabilité des réactifs utilisés dans les études pour le dosage chronométrique d’efanesoctocog alfa, selon (8,9).
Table 1: Acceptability of reagents used in studies for the chronometric assay of efanesoctocog alfa, according to (8,9).
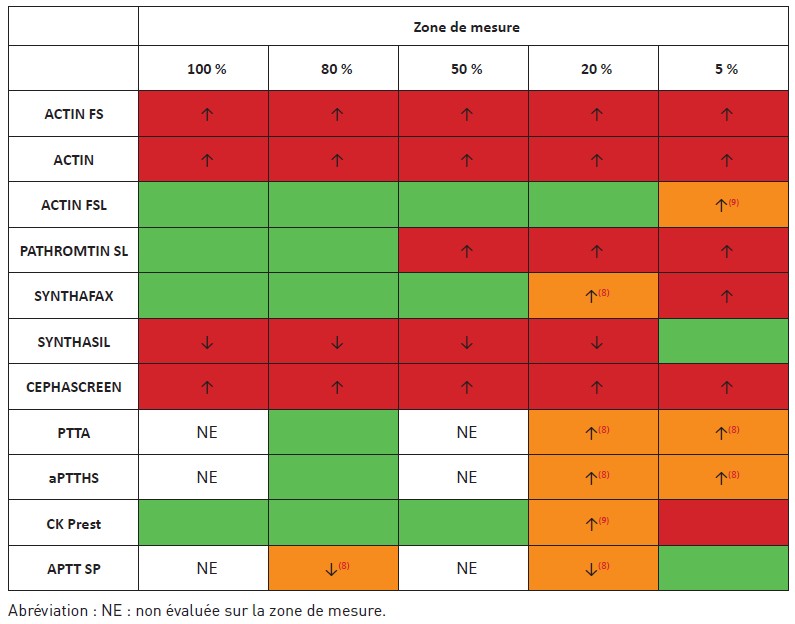
Légende : Case verte : réactif acceptable sur la zone de mesure selon les critères des auteurs ; case rouge : réactif non acceptable sur la zone de mesure selon les critères des auteurs ; case orange : résultat à confirmer car surestimation ou sous-estimation détectée sur une seule étude dont la référence est indiquée en exposant.
Dans cette même étude, 8 réactifs différents ont été utilisés pour la technique chromogénique. Les résultats montraient une surestimation systématique pour tous les taux d’efanesoctocog alfa (270 %, 265 % et 271 % des valeurs attendues pour les taux à 80 %, 20 %, et 5 %
respectivement) alors qu’aucune différence significative n’était observée pour l’octocog alfa. Ces résultats discordants ont été confirmés lors d’une seconde étude européenne organisée par les deux sociétés de contrôle externe de la qualité : ECAT et NEQASBC (9). Les 300 centres participants recevaient des plasmas déficients FVIII surchargés en efanesoctocog alfa à 100 %, 50 %, 20 % et 5 %. Selon le même principe, les activités de FVIII étaient mesurées par chaque laboratoire, en aveugle, avec leur
couple réactif/automate usuel en technique chronométrique et/ou en technique chromogénique. Une différence de +/- 25 % par rapport aux taux cibles était jugée comme acceptable. Dans cette étude, tous les réactifs utilisés pour le dosage chromogénique entraînaient une surestimation (248 % à 138 % des cibles attendus) et aucun réactif utilisé pour le dosage chronométrique ne permettait d’être acceptable sur l’ensemble de la gamme de mesure (100 % à 5 %), y compris pour l’Actin FSL pourtant considéré comme réactif de référence. L’Actin FSL mais également le Synthafax surestimaient en effet le taux à 5 % mais donnaient des résultats acceptables aux niveaux 100 %, 50 % et 20 %. Les réactifs Pathromtin et le CK Prest surestimaient les taux inférieurs à 50 % alors que l’Actin FS surestimait de plus de 200 % les 4 niveaux évalués.
La difficulté concernant le dosage d’efanesoctocog alfa a donc incité certains auteurs à calibrer le dosage chronométrique (10) ou le dosage chromogénique (11) avec la molécule. Cette calibration spécifique permet pour le dosage chronométrique d’utiliser des réactifs proscrits
en calibration classique et de retrouver des résultats comparables à ceux obtenus avec l’Actin FSL, considéré comme le réactif de référence (10). La calibration spécifique du dosage chromogénique permet également de retrouver des résultats justes, sans surestimation quel que soit le type de réactif utilisé. Elle permet également de répondre à deux situations cliniques où la présence d’emicizumab peut interférer avec le dosage chronométrique (12) d’efanesoctocog alfa :
• Mesure de l’activité résiduelle d’efanesoctocog alfa à J+7 chez un patient qui change de traitement prophylactique (passage d’emicizumab à efanesoctocog alfa) ;
• Mesure de l’activité d’efanesoctocog alfa au décours d’une chirurgie chez un patient hémophile A traité en prophylaxie par emicizumab.
Il n’existe pas d’effet cumulatif de l’efanesoctocog alfa en présence d’emicizumab (13) mais l’emicizumab interfère avec le dosage chronométrique du FVIII et cela jusqu’à plus de 6 mois après l’arrêt du traitement par emicizumab (14). Le dosage chromogénique du FVIII en calibration habituelle surestime l’efanesoctocog alfa, seul le dosage chromogénique (réactif bovin ou mixte) calibré spécifiquement permet de rendre un résultat exact dans ces 2 situations (11).
Si la solution d’une calibration spécifique pour le dosage de l’activité d’efanesoctocog alfa est souhaitable (15), elle se heurte néanmoins à la disponibilité d’un calibrant et de contrôles de qualité internes titrés en efanesoctocog alfa. La mise à disposition de ces types de réactifs serait prévue pour 2026.
Plusieurs équipes ont également évalué l’efanesoctocog grâce au test de génération de thrombine (13). Il s’agit à ce jour principalement d’études in vitro démontrant la capacité de l’efanesoctocog alfa à corriger l’hémostase d’un plasma déficient en FVIII à des taux habituels de FVIII.
D’AUTRES PARTICULARITÉS BIOLOGIQUES DE L’EFANESOCTOCOG ALFA
Par rapport au facteur VIII physiologique, les modifications structurales apportées au rFVIII pour l’efanesoctocog alfa entraîneraient également une stabilité supplémentaire. Ainsi, les techniques de dépistage et titrage des inhibiteurs anti-FVIII (méthode Bethesda, méthode Nijmegen) semblent devoir être adaptées. En effet, la première étape de ces méthodes consiste en l’élimination de tout facteur VIII dans le plasma, afin d’éviter des résultats faussement négatifs ou une sous-estimation des titres d’inhibiteurs. Cette étape est réalisée classiquement en chauffant le plasma du malade trente minutes à 56 °C. Si ce temps d’incubation suffit pour dégrader le FVIII physiologique ou les FVIII recombinants (EHL, non EHL), il semble que cette durée soit insuffisante pour dégrader la totalité de l’efanesoctocog alfa (16,17). Lorsqu’une recherche d’inhibiteur est indiquée chez un patient traité par efanesoctocog alfa, il est donc recommandé de modifier cette première étape en prolongeant le temps d’incubation au-delà d’une heure, voire 90 minutes.
La structure modifiée et la présence de groupement XTEN pouvant influencer l’immunogénicité de ce nouveau rFVIII, il est pertinent de s’interroger sur la spécificité des techniques classiques de dépistage et titrage des inhibiteurs anti-FVIII qui utilisent comme source de FVIII des plasmas contenant du FVIII physiologique et non de l’efanesoctocog alfa. L’équipe de l’université de Standford a d’ailleurs présenté à l’ISTH en 2025 l’impact de la région D’D3 de l’efanesoctocog alfa : cette région D’D3 diminuerait la fixation d’anticorps monoclonaux IgG dirigés contre les domaines du FVIII (18). Si ces résultats sont confirmés, il semblerait donc logique d’adapter les méthodes de Bethesda/Nijmegen en utilisant une source d’efanesoctocog alfa pour ne détecter que les anticorps spécifiquement dirigés contre cette molécule. Cette thérapeutique étant récente et aucune étude chez les PUPS (enfants jamais traités par FVIII) n’ayant été conduite, la question reste entière.
CONCLUSION
Avec l’apparition d’une nouvelle classe de facteur VIII, les techniques classiques de mesure d’activité du FVIII sont majoritairement à adapter dans les laboratoires pour assurer la disponibilité d’un dosage juste et précis. La calibration spécifique des techniques de dosages chronométriques ou chromogéniques du FVIII semble pertinente. La disponibilité prochaine d’un calibrant et de contrôles de qualité interne efanesoctocog alfa sur le marché des réactifs permettra une surveillance biologique adaptée chez les patients traités par efanesoctocog alfa. L’inscription par ECAT de la mesure de l’efanesoctocog alfa aux exercices de contrôle externe disponibles en 2026 montre la volonté de la communauté scientifique de disposer d’un dosage spécifique contrôlé. Les particularités structurales et
pharmacocinétiques de l’efanesoctocog alfa impactent non seulement la mesure d’activité mais également la surveillance biologique dans sa globalité et de nombreuses évolutions sont à prévoir :
• Faut-il une nouvelle façon de dépister les inhibiteurs chez les patients traités par efanesoctocog alfa ?
• Y-a-t-il un intérêt à réaliser des pharmacocinétiques ou à doser l’activité résiduelle en prophylaxie ?
Les réponses à ces questions viendront sans doute avec les résultats d’études en données réelles.
POINTS CLÉS À RETENIR
• Le dosage de FVIII:C doit être adapté pour la surveillance biologique des patients traités par efanesoctocog alfa.
• Pour le dosage chronométrique de FVIII:C, certains réactifs entraînent une surestimation, d’autres une sous-estimation selon le domaine de mesure.
• Le dosage chromogénique de FVIII:C surestime l’activité ; seule la calibration avec un calibrant spécifique permet une mesure exacte en s’affranchissant des interférences de l’emicizumab (intérêt en cas de switch ou de chirurgie par exemple).

